Door de binding aan sterolen in het celmembraan te manipuleren, kan een belangrijk maar ook zeer toxisch antischimmelmiddel een stuk veiliger worden voor patiënten, schrijven Amerikaanse chemici in Nature.
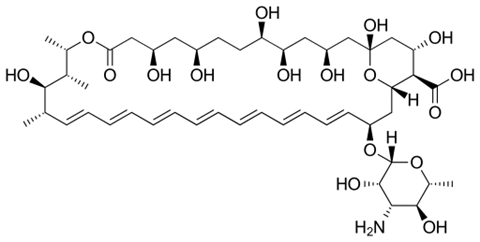
Amfotericine B is een antischimmelmedicijn dat artsen als laatste redmiddel gebruiken bij een infectie met een schimmel die resistent is tegen de standaard, eerste keus middelen. Een groot nadeel van amfotericine B is dat het zeer schadelijke bijwerkingen heeft, vooral de toxiciteit voor de nieren is berucht. Een team onder leiding van chemicus Martin Burke van de University of Illinois, Urbana-Champaign zijn er nu in geslaagd om de structuur van het moleculen zo aan te passen dat het niet langer toxisch is, terwijl de werkzaamheid is behouden.
Jaarlijks overlijden wereldwijd anderhalf miljoen mensen aan een ernstige schimmelinfectie. Ter vergelijking; wereldwijd sterven er jaarlijks 700.000 mensen aan een infectie met resistente bacteriën en ruim 600.000 aan malaria. Als bij een bacteriële infectie de antibiotica niet aanslaat, zijn er vaak nog wel alternatieven. Bij een resistente schimmel zijn die er nauwelijks. Dat komt onder andere doordat er veel minder onderzoek wordt gedaan naar resistente schimmelinfecties dan naar antibiotica-resistente bacteriën.

Dilemma
Amfotericine B is al sinds 1960 een van de weinige mogelijkheden die artsen nog hebben als andere middelen niet aanslaan. Het doodt veel verschillende schimmelsoorten en er treedt zelden resistentie op. Belangrijke voordelen, maar er is ook een groot nadeel: het middel is giftig, zeker in de nieren. ‘Tijdens mijn co-schappen noemden we het middel ook wel ampho-terrible’, vertelt Martin Burke in een Nature podcast. ‘Meteen nadat je het middel aan de patiënt geeft, treedt er een zeer onaangename koortsreactie op. Nog erger is dat het op lange termijn zeer giftig voor de nieren is.’ Met name bij infecties met mucor- of rhizopus-schimmels zijn hoge doseringen nodig. Dat stelt artsen voor een moeilijk dilemma op: een hoge dosis veroorzaakt ernstige nierbeschadiging, maar bij een te lage dosis bestrijd je de schimmel niet.
Burke en collega’s ontdekten dat amfotericine schimmelcellen doodt door sponsachtige aggregaten op het celoppervlak te vormen die sterolen uit het celmembraan verwijderen. Die sterolen zijn essentieel voor het membraan. Zonder gaat de schimmel dood. In het membraan van menselijke zit cholesterol, dat sterk lijkt op de schimmelsterolen. Amfotericine verwijdert cholesterol op een vergelijkbare manier uit het membraan, blijkt uit het onderzoek van Burke. Vandaar de toxiciteit in patiënten. Het team kwam dit op het spoor door analogen van amfotericine B te onderzoeken, waarbij ze de structuur op een bepaalde plaatsen varieerden. Zo konden ze bekijken hoe structurele veranderingen de biologische activiteit van het medicijn beïnvloeden. Door vervolgens deze analogen in menselijke niercellen en in muizen toe te passen, zagen ze dat niertoxiciteit wordt veroorzaakt door de binding van amfotericine B aan cholesterol in het niercelmembraan.
Ietsje zwakker
Dat leverde aanknopingspunten om die toxiciteit te omzeilen. ‘Toen we eenmaal wisten hoe het middel de niercellen kapotmaakt, wilden we dat veranderen. Zodat het alleen schimmelcellen zou doden’, zegt Burke in de podcast. Hoge-resolutie NMR structuren van amfotericine B met en zonder gebonden sterolmoleculen lieten zien dat dat de binding van amfotericine aan de schimmelsterolen heel sterk is. Veel sterker dan de binding aan de menselijke sterolen. Dat bracht ze op een idee. Burke: ‘Wat als we die binding iets minder sterk maken zodat het middel geen cholesterol meer kan binden en de verbinding met het schimmelsterol alleen iets zwakker wordt?’
De eerste aangepaste amfotericine-analoog, bewees dat dit kon. Er was alleen één probleem: de potentie was veel minder. Schimmel maakten sneller nieuw ergosterol aan, dan het molecuul kon verwijderen. De onderzoekers deden daarom nog een aanpassing aan de structuur die ervoor zorgt dat de nieuwe variant ergosterol nog sneller verwijdert. Het resultaat: molecuul AM-2-19, vernoemd naar gedeeld-eerste auteur Arun Maji. Tot slot testten ze AM-2-19 in vitro tegen 500 verschillende schimmelsoorten. ‘Het bleek heel potent’, aldus Burke in de podcast. En ze voerden nog toxiciteitsstudies uit menselijke niercellen en in muizen met schimmelinfecties. AM-2-19 bleek effectief, zonder giftig te zijn.
Indrukwekkend
‘De design-by-structure-chemie van dit onderzoek vind ik zeer indrukwekkend’, reageert klinisch farmacoloog Roger Brüggemann die in het Radboudumc onderzoek doet naar resistente schimmelinfecties. ‘Het is heel volledig doordat ze én de structuur hebben opgehelderd met NMR en die interactie met het sterol hebben onderzocht, én die binding wisten te manipuleren, én nog labonderzoek, dieronderzoek en onderzoek met humane cellen hebben gedaan.’ Brüggemann wijst er verder op dat het ergosterolverwijderingsmechanisme in meer antischimmelmiddelen uit dezelfde familie voorkomt, waardoor deze aanpassingen wellicht voor meer middelen bruikbaar zijn.
Waarom de tweede aanpassing van AM-2-19 voor het gewenste effect zorgde, weten de onderzoekers nog niet. Daar is vervolgonderzoek voor nodig, maar voor nu is het team van Burke blij met het resultaat. Ze zien er zoveel potentie in dat Burke een bedrijf heeft opgericht, Sfunga Therapeutics, om het molecuul verder te ontwikkelen. Recent zijn de eerste klinische trials begonnen. Brüggemann: ‘Ik ben heel benieuwd naar de uitkomsten. Een middel met deze werking zonder toxiciteit is precies waar we naar op zoek zijn.’
Nature podcast van 8 november 2023 met daarin ook Martin Burke



















Nog geen opmerkingen