Biochemici van de Universiteit Utrecht hebben een fluorescente sensor ontwikkeld die DNA-schade en -herstel voor het eerst in real-time zichtbaar maakt in levende cellen en dieren. In Nature Communications laten ze zien hoe de sensor aan beschadigd DNA bindt zonder het reparatieproces te hinderen.
Ons DNA loopt voortdurend beschadigingen op, bijvoorbeeld door zonlicht, chemische stoffen of tijdens het replicatieproces. De cel hanteert verschillende eiwitten om de DNA-breuken die hierbij ontstaan snel en efficiënt te repareren. Wanneer dit mislukt heeft dat vaak nadelige gevolgen. Vanwege de grote rol in veroudering, kanker en andere ziekten willen onderzoekers dit herstelproces daarom zo goed mogelijk kunnen volgen.
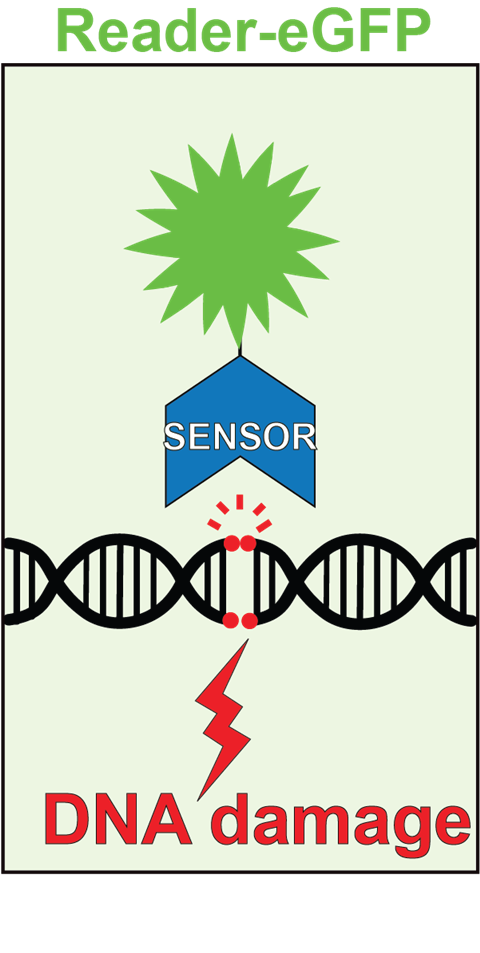
Er bestaan al enkele technieken om DNA-herstel zichtbaar te maken. Doorgaans bindt hierbij een fluorescent eiwit aan een breuk in de dubbele strengen van het DNA. Het probleem is dat het herstelproces met de huidige ontworpen eiwitten niet volledig vrij te volgen is. Waar het ene eiwit enkel bruikbaar is tijdens bepaalde stadia van de celcyclus, brengt de andere enkel momentopnamen in beeld in gefixeerde (en dus dode) cellen. Daarbij binden sommige eiwitten, zogeheten nanobodies, zodanig stevig aan de DNA-breuk dat ze niet meer loslaten en het reparatiesysteem van de cel in de weg zitten.
Nu hebben onderzoekers van de Universiteit Utrecht een nieuwe fluorescente sensor ontwikkeld die zichtbaar maakt hoe DNA-schade ontstaat en weer verdwijnt in levende cellen. ‘Onze techniek heeft geen voorwaarden’, zegt biochemicus Tuncay Baubec van de Universiteit Utrecht, die het onderzoek leidde. ‘Het kan ten allen tijde DNA-schade detecteren, zonder reparatieprocessen te hinderen.’
Lego-eiwit
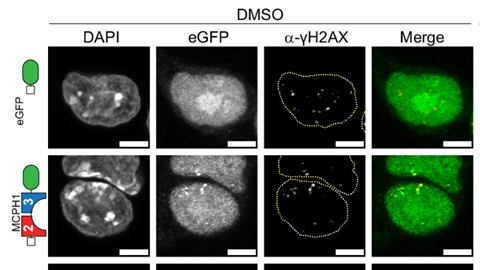
Voor hun sensor gebruikten de onderzoekers een domein van een natuurlijk eiwit, het tandem-BRCT-domein van MCPH1, waar ze het fluorescente label GFP aan koppelden. Het gekozen domein bindt namelijk met hoge affiniteit aan een histonmarkering die kenmerkend is voor beschadigd DNA, γH2AX. Hierbij hecht het zich zwak en tijdelijk vast aan de DNA-breuk, waardoor de schade kort oplicht en het herstelproces vervolgens ongehinderd voort kan zetten.
De onderzoekers kwamen tot de ontdekking van dit domein door talloze domeinen uit verschillende eiwitten te testen. ‘Wij zien eiwitdomeinen als kleine bouwsteentjes die je uit eiwitten kunt halen en net als Lego weer in elkaar kunt zetten tot nieuwe eiwitten’, zegt Baubec. ‘In het lab kloonden we verschillende domeinen tot synthetische eiwitten die we vervolgens parallel gingen testen in onze assays. Zo botsten we op dit domein, dat de precieze selectiviteit had die we zochten.’
Breed inzetbaar
Bioloog Richard Cardoso da Silva ontwierp en testte de sensor. ‘Als eerste bekeken we welke domeinen op dezelfde plek bonden in gefixeerde cellen als conventionele antilichamen die aan DNA-breuken hechten. Vervolgens onderzochten we de werking van de uiteindelijke sensor in levende cellen bij een aantal medicijnen die DNA-schade opwekken op verschillende tijdschalen. Hierbij zagen we de oplichtende breuken na een tijd weer verdwijnen, wat ons vertelde dat de cel de schade kon herstellen.’
Met time-lapse-microscoopvideo’s van veertien uur toonden de onderzoekers aan dat de sensor het hele proces, van breuk tot reparatie, aan het licht kan brengen in verschillende cellijnen. Ook werkten ze samen met collega’s van de Universiteit Utrecht om het synthetische eiwit in de C. elegans worm toe te passen, waar het eveneens DNA-breuken liet oplichten. Cardoso da Silva: ‘We laten zien dat de sensor in principe in verschillende cellen en levende organismen inzetbaar is.’
Vissen naar eiwitten
Als volgende stap willen de onderzoekers hun sensor gebruiken om te bepalen welke eiwitten allemaal betrokken zijn bij de reparatie van DNA-breuken. ‘De grote vraag in ons onderzoeksveld is welke factoren een rol spelen in DNA-herstel’, zegt Baubec. ‘Dit varieert van plek tot plek in het genoom, is afhankelijk van in welke fase je zit van de celcyclus, en ga zo maar door. Met onze sensor kunnen we nu gaan onderzoeken wat er wanneer gebeurt.’
Door het synthetische eiwit aan te lengen met een biotine-ligase willen de onderzoekers hengelen naar de eiwitten die het DNA komen herstellen. ‘Er bestaan al methoden die biotine-ligase gebruiken om te binden aan nabijgelegen eiwitten’, zegt Baubec. ‘Met onze sensor zouden we op die manier alle eiwitten in de omgeving rondom een DNA-breuk kunnen labelen. Zo vis je de belangrijke eiwitten uit de soep van alle eiwitten die in een cel rondzweven.’
da Silva, R.C. et al. (2025) Nat. Commun. 16, DOI: 10.1038/s41467-025-65706-y



















Nog geen opmerkingen