Met triazine-thioluitwisseling kon een groep uit Nijmegen cysteïnemodificaties in peptiden programmeren door de pH te variëren, zo melden zij in ChemistryEurope.
Het modificeren van peptiden of eiwitten voor therapeutische toepassingen brengt de uitdaging van selectiviteit met zich mee. ‘Deze biomoleculen hebben veel verschillende functionele groepen, dus het is niet eenvoudig om er één selectief te modificeren’, zegt Kevin Neumann, universitair docent aan de Radboud Universiteit (RU). ‘Naast het selecteren van de beoogde functionaliteit, zou het mooi zijn om te kunnen controleren wáár een modificatie plaatsvindt. We willen natuurlijk cytotoxische medicijnmoleculen aan iets hechten, dus idealiter willen we precies weten welke en hoeveel plekken er hebben gereageerd.’
Daarom richten de meeste labelingsstrategieën zich op cysteïnen, legt Katerina Gavriel, promovendus in de precisiechemiegroep van Neumann, uit. ‘Cysteïnen komen doorgaans zelden voor in eiwitten en zijn ook zeer nucleofiel bij lagere pH-waarden. Dit betekent dat, wanneer concurrerende lysinegroepen inactief zijn, cysteïnen beschikbaar blijven voor modificatie.’
Verrassing
Het huidige project kende een onverwachte start. ‘We hadden een studente, Daniëlle Geers, die nog een paar weken te gaan had op haar oorspronkelijke project’, zegt Gavriel. ‘Terwijl wij hard werkten aan een tetrazinemodificatie, lieten we haar soortgelijke chemie met triazines uitproberen.’ Tot hun verrassing werkte dat heel goed en bood het nieuwe reactiviteit. ‘We hadden niet voorzien dat haar eerste bevindingen zouden leiden tot zo’n groot en spannend project’, beaamt Neumann.
Voorheen wisten onderzoekers wel welk soort entiteiten ze konden modificeren, maar vaak ontbrak het bij deze benaderingen aan site selectivity, d.w.z. controle over waar reacties plaatsvinden. Tijdens colleges gebruikt Neumann meestal de illustratie van een doos met drie appels en twee bananen om dit uit te leggen. ‘Een appel pakken in plaats van een banaan zou chemoselective zijn, maar we willen een van de drie appels kiezen, wat site selectivity symboliseert.’
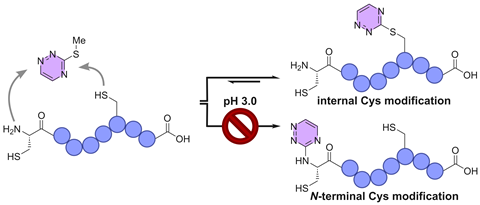
‘Eerdere onderzoekers kregen site selectivity voor elkaar op het N-uiteinde van een eiwit, maar niet op de ruggengraat – althans niet selectief, zonder dat je beschermengroepen nodig had’, voegt Gavriel toe. Maar dat is precies wat zij en haar collega’s hebben bereikt, zoals blijkt uit hun publicatie in ChemistryEurope. Afhankelijk van de pH kon het team ofwel de cysteïne aan het N-uiteinde ofwel de ruggengraat van het eiwit modificeren met behulp van triazine-thioluitwisseling.
Praktisch
Het mechanisme van selectiviteit was echter onduidelijk, legt Gavriel uit. ‘Onze grootste uitdaging was uitpluizen wat het mechanisme van de selectiviteit was. We zagen dat het gebeurde, maar we wilden meer weten.’ De Neumann-groep wendde zich tot Jan Meisner, hoogleraar aan de Heinrich Heine Universiteit (Duitsland), die hen hielp met computationele studies als aanvulling op hun NMR-tests. ‘Het laat zien waarom een samenwerking tussen computationele chemici en experimentalisten altijd loont’, zegt Neumann.
Een andere uitdaging was meer praktisch van aard. Gavriel zegt dat het verminderen van de reactiviteit van de heterocyclus om de selectiviteit te verhogen, de reactiesnelheid vertraagde. ‘Er was concurrentie tussen onze reactie en de vorming van disulfiden, iets wat we nog moeten overwinnen.’ De groep werkt daarom actief aan het vinden van de juiste balans tussen controle en snelheid.
Desalniettemin is dit ‘een geweldige fundamentele prestatie voor een eerste poging’, vervolgt Neumann. ‘Dit gaat zeker toepassing vinden in drug conjugates. Voor sommige toepassingen is een dergelijke controle essentieel, bijvoorbeeld voor antibody drug conjugates. We zijn erin geslaagd het onderzoek van kleine moleculen door te vertalen naar grote peptiden.’ Een ander voordeel van dit niveau van controle heeft betrekking op beleid. ‘De FDA wil weten wat ze precies goedkeuren. Als je ze kunt vertellen op welke cysteïne je modificatie exact aanwezig is, verloopt het goedkeuringsproces veel sneller, wat interessant is voor farmaceutische bedrijven. Met andere woorden, het is tijd om samen te werken met grotere bedrijven om dit echt van de grond te krijgen.’
Gavriel, K. et al. (2025) ChemistryEurope 3(5), DOI: 10.1002/ceur.202500273




















Nog geen opmerkingen