Hoe stabiel amidepolymeren zijn die met waterstofbruggen aan elkaar zitten hangt af van welk atoom je op de plek van de zuurstof zet, schrijft de TheoCheM-groep in Chemistry – a European Journal.
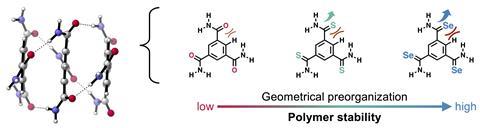
Bij biosupramoleculaire systemen en de synthetische evenknie daarvan wordt veel gebruik gemaakt van waterstofbruggen. Zo ook bij polymeren die met waterstofbruggen aan elkaar zijn gekoppeld. Recent onderzoek liet zien dat als je het zuurstofatoom in benzeen-1,3,5-tricarboxamides (BTA’s) vervangt door zwavel of selenium, je een stabieler polymeer krijgt. De redenen daarachter waren alleen niet heel duidelijk, maar Celine Nieuwland, Célia Fonseca Guerra en collega’s van de Vrije Universiteit Amsterdam komen met een ontwapenend eenvoudige uitleg.
‘Het begon eigenlijk vorig jaar al’, vertelt Nieuwland. ‘Toen publiceerden Célia en ik al een paper over een vraag uit de organische katalyse: uit experimenten bleek dat thioamides [amides met zwavel, red.] betere waterstofbrugdonoren zijn dan “normale” amides met zuurstof.’ Het veld opperde resonantiestructuren als verklaring, omdat je op basis van elektronegativiteit het tegenovergestelde zou verwachten, maar over die uitleg was het Amsterdamse team niet tevreden.
‘Wat we vonden was dat het te maken had met de grootte van het atoom, preciezer de sterische Pauli-repulsie’, legt de PhD-student uit. Hoe groter het atoom X in de amide C=X-binding, hoe groter de sterische repulsie, hoe langer de C=X binding. Deze bindingsverlenging verlaagt het π*C=X-orbitaal wat hierdoor elektronen ‘wegtrekt’ van het stikstofatoom. ‘De aminogroep is hierdoor iets meer positief geladen, en dus een sterkere waterstofbrugdonor.’
Voor de hand
Eenzelfde effect zagen de onderzoekers in de supramoleculaire chemie bij de BTA’s. ‘We wilden graag weten hoe onze fundamentele bevinding over amides zich vertaalt naar de supramoleculaire chemie’, zegt Nieuwland. ‘De uitleg uit het veld was opnieuw aan de hand van resonantiestructuren, maar dat strookt niet met de werkelijkheid. Dus onderzochten we hoe het écht zit.’
Er zijn meerdere redenen waarom zwavel-BTA’s en selenium-BTA’s een stabieler polymeer geven. Doordat zwavel en selenium groter zijn dan zuurstof, is er een grotere verstoring in de structuur van de monomeren. Dat maakt dat monomeren makkelijker op elkaar aan kunnen sluiten. Nieuwland: ‘Het lag best wel voor de hand, maar de experimentatoren hebben het over het hoofd gezien. Het is een belangrijk punt voor materiaalontwerp: je moet goed kijken naar de structuur van je monomeren in een polymeer, want kleine verschillen kunnen dus een groot verschil maken in bijvoorbeeld het vormen van waterstofbruggen.’
Hemoglobine
Een tweede reden heeft te maken met de bevindingen van vorig jaar. ‘Amides met zwavel of selenium geven sterkere orbitaalinteracties en dus sterkere covalente interacties in de waterstofbruggen’, legt Nieuwland uit. ‘Tegelijk heeft een groter atoom meer elektronen, waardoor je meer en betere dispersie ofwel Vanderwaalsinteracties hebt.’
De covalente interacties in de waterstofbruggen zorgen er tevens voor dat er een grotere stabiliteit wordt behaald bij het toevoegen van een monomeer aan een BTA-dimeer ten opzichte van het vormen van een dimeer. ‘Je kunt het vergelijken met hemoglobine. Als hemoglobine één zuurstofmolecuul bindt, dan neemt de affiniteit om nog een zuurstofmolecuul te binden toe. Dat werkt in deze polymeren hetzelfde met de sterkte van de waterstofbruggen.’ Nieuwland concludeert: ‘De paper laat in mijn ogen zien dat kwantumchemische berekeningen ook echt belangrijk zijn voor het begrijpen van macromoleculaire structuren, niet alleen voor kleine moleculen.’
Nieuwland, C. et al. (2023) Chem. Eur. J. e202300850, DOI: 10.1002/chem.202300850




















Nog geen opmerkingen