Biochemici van de Universiteit Utrecht presenteren samen met internationale collega’s in PNAS een nieuwe meetmethode, FibrilPaint, die de groei van schadelijke eiwitklonten in de hersenen zichtbaar maakt.
Een groot probleem bij het vaststellen van dementie is dat de diagnose vaak te laat gebeurt. Eens geheugenverlies wordt gedetecteerd, is de meeste breinschade al aangericht. De leidende hypothese voor de oorzaak van dementie en andere neurologische degeneratieziekten, waaronder parkinson en huntington, is de vorming van zogeheten amyloïde-fibrillen in de hersenen. Dit zijn dunne, vezelachtige eiwitklonten die jarenlang in stilte kunnen groeien, zonder dat een patiënt het doorheeft. Dit soort vroege veranderingen zijn met bestaande technieken nog nauwelijks in kaart te brengen.
Daar kan nu verandering in komen. Onderzoekers uit de groep van biochemicus Stefan Rüdiger van de Universiteit Utrecht hebben samen met internationale collega’s een nieuwe meetmethode ontwikkeld die de groei van amyloïde-fibrillen zichtbaar maakt.
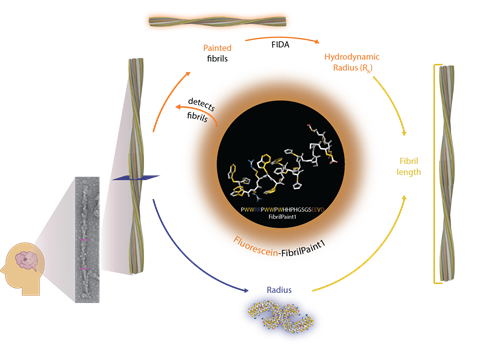
De techniek, FibrilPaint, bestaat uit een speciaal ontworpen fluorescente peptide dat met hoge affiniteit aan de eiwitdraden bindt – het ‘verft’ ze. Hiermee valt bloed of ruggenmergvloeistof van patiënten direct door te meten voor de aanwezigheid van fibrillen.
‘Haast alle centrale eiwitten in verschillende neurodegeneratieve ziektes, van alzheimer tot huntington, vormen amyloïde-structuren’, zegt gedeelde eerste auteur en biochemicus Júlia Aragonès Pedrola van de Universiteit Utrecht. ‘Omdat FibrilPaint niet aan een specifiek eiwit bindt maar aan de fibrillen, is het daardoor inzetbaar voor al deze aandoeningen.’
Moleculen meten
Oorspronkelijk werkte Rüdiger met collega’s aan een heel andere vraag: hoe bepaalde eiwitten, zogeheten moleculaire chaperonnes, de aggregatie van amyloïde-fibrillen in een gezond brein tegengaan. Om dit te onderzoeken zocht hij naar een techniek om de lengte van de fibrillen te meten. Hij botste uiteindelijk op een recent ontwikkeld microfluïdisch capillair, FIDA, waarmee de lengte van moleculen valt te kwantificeren. ‘Die techniek leek ons perfect’, zegt Rüdiger. ‘Al zaten we met het probleem dat je er alleen fluorescente moleculen mee kon meten. Daarom gingen we aan de slag om een fluorescent peptide te ontwikkelen dat enkel aan de fibrillen zou binden en verder niets.’
Amyloïde-fibrillen bestaan uit op elkaar gestapelde draden van een herhalend eiwit. Met succes ontwierpen de onderzoekers een fluorescent peptide dat zich enkel aan deze draden hecht. Daarbij laat het monomeren en andere aggregaten met rust. Hoe het dit doet, is voor de onderzoekers nog een vraag. ‘Hoewel we hebben gemeten dat FibrilPaint met nanomolaire affiniteit aan de fibrillen hecht, hebben we nog geen plaatje van hoe het precies bindt’, zegt Rüdiger. ‘We verwachten dat de peptide de opeengestapelde lagen overbrugt en daarbij aan meerdere draden bindt, wat de relatief hoge affiniteit zou verklaren.’

Peptiden doorspitten
Samen met internationale collega’s ontwikkelden en synthetiseerden de Utrechtse onderzoekers de peptide. ‘Eerst hebben we een grote set aan mogelijke peptiden onderzocht op welke het beste met amyloïde-fibrillen bond’, zegt gedeelde eerste auteur en biochemicus Françoise Dekker van de Universiteit Utrecht. ‘Dit deden we met behulp van Thioflavine T [ThT, red.], een kleurstof die een signaal geeft dat afhankelijk is van de groei van amyloïde-aggregaten. Wanneer een peptide bindt met de fibrillen, heeft dit invloed op het signaal van de ThT.’
Hiermee definieerden de onderzoekers een subset van vier peptiden die konden binden aan verschillende neurodegeneratieve eiwitten, waaronder het tau-eiwit dat een grote rol speelt in alzheimer. Aan de hand van verdere optimalisatiestappen voor het zo goed mogelijk meten van de lengte van de fibrillen kwamen ze tot de beste kandidaat.
Klinische validatie
Ondertussen timmeren de onderzoekers hard aan de weg om FibrilPaint naar de gezondheidssector te brengen. Dekker is nu CEO van een start-up, NeuroTidal Diagnostics, dat de meetmethode wil toepassen in klinische studies die zoeken naar medicijnen tegen dementie. Dekker: ‘Momenteel zijn we een grote groep patiëntensamples aan het screenen met FibrilPaint.’
Naast diagnose is de peptideverf mogelijk ook inzetbaar als therapie. Het doet namelijk ook dienst als een molecuul dat het cellulair afbraaksysteem aantrekt om een bepaald eiwit op te ruimen (PROTAC). ‘Nadat FibrilPaint met amyloïde-fibrillen bindt, kan het de machinerie van cellen signaleren om deze af te breken’, zegt Aragonès Pedrola. ‘Hoewel we nu nog aan het valideren zijn of deze afbraak lukt, hebben we al wel aangetoond dat de signalering werkt.’
Aragonès Pedrola, J., Dekker, F.A. et al. (2025) PNAS 122(44), DOI: 10.1073/pnas.2502847122




















Nog geen opmerkingen