Celdeling klinkt zo simpel. Toch is dit een van de meest fundamentele moleculair-biologische processen. En aan de basis daarvan staat de celcyclus, een set biochemische interacties die ervoor zorgen dat de nieuwe cel alle eigenschappen meekrijgt die er op dat moment en op die plaats in het lichaam nodig zijn.
- Verdubbelen en verdelen
- Checkpoints
- Cellulaire veroudering
- Tien biljard celcycli
- Cyclins
- Aurora B kan er (niet) bij
Verdubbelen en verdelen
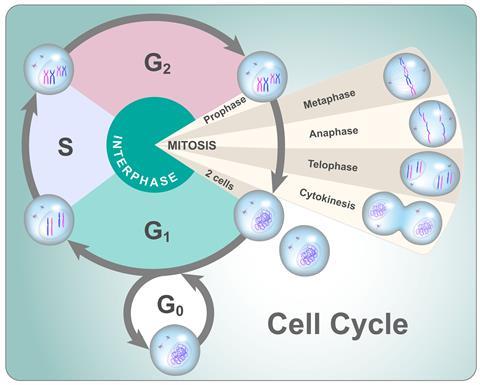
Het basisprincipe van de celcyclus is in alle organismen hetzelfde, al zijn er wel duidelijke verschillen tussen met name prokaryoten (organismen zonder celkern, zoals bacteriën) en eukaryoten (organismen met celkern, zoals zoogdieren). In dit dossier beperken we ons tot eukaryoten. Biologen hebben de celcyclus van eukaryoten opgedeeld in twee hoofdstadia die elk weer zijn onderverdeeld in specifiekere fases.
Interfase
De eerste van de twee hoofdstadia van de celcyclus heet interfase en duurt met 23 uur verreweg het langst. Interfase bestaat zelf ook weer uit drie afzonderlijke fasen die we aanduiden met G1, S en G2. Gedurende de 11 uur die G1 duurt, verdubbelt de cel zijn inhoud, verzamelt energie en maakt voldoende bouwstenen aan om zich voor te bereiden op wat komen gaat. Als gevolg hiervan groeit de cel in omvang.
In S-fase (‘synthesis’), die 8 uur duurt, draait alles om de replicatie: de verdubbeling van het DNA. Dit proces wordt door honderden verschillende eiwitten gestuurd en bewaakt. En met reden, want zelfs een kleine fout in deze fase kan desastreuze gevolgen hebben.
DNA heeft de vorm van een wenteltrap, de beroemde dubbele helix. De twee DNA strengen zijn elkaars spiegelbeeld zijn en kronkelen om elkaar heen. Als eerste stap ritst het eiwit helicase de beide strengen open, waarna een tweede eiwit, DNA-polymerase, een kopie maakt van beide gescheiden helften. Andere eiwitten combineren de oude en nieuwe helften vervolgens weer tot twee identieke kopieën. DNA-replicatie tijdens S-fase kost veel energie en grondstoffen, waar de cel enige tijd van moet bijkomen. Daar gebruikt het G2 voor, die zo’n vier uur in beslag neemt. De cel neemt op dat moment verder in omvang toe, vult de voorraden energie, bouwstoffen en eiwitten weer aan, en treft voorbereidingen voor de stap naar het volgende stadium.
M-fase
Dat tweede hoofdstadium van de celcyclus noemen we M-fase (‘mitosis’). Hoewel er veel gebeurt tijdens mitose, heeft een cel daar slechts één uur voor nodig. In M-fase trekt de cel de verdubbelde chromosomen gecontroleerd uit elkaar, iedere set naar een eigen kant van de cel. Deze chromosoom-verdeling gebeurt in vier stappen. Pas tijdens de allerlaatste stap in M-fase, de cytokinese, vindt de daadwerkelijke celdeling plaats. De celmembraan snoert in, zodanig dat er twee cellen ontstaan met ieder een eigen kopie van het DNA.
Checkpoints
Tijdens alle fasen van celcyclus-progressie kan er iets misgaan, maar met name de S-fase, dus het kopiëren van de miljarden nucleotiden van het DNA binnen acht uur, is cruciaal. DNA-polymerase jakkert met een snelheid van zo’n vijftig nucleotiden per seconde over het DNA om de kopie te maken. Daardoor kun je uitrekenen hoeveel DNA-polymerases er minimaal tegelijk aan het werk moeten zijn in S-fase in één enkele cel: 2 sets van 23 chromosomen met in elke set 3.000.000.000 nucleotiden in duplo/spiegelbeeld, 50 nucleotiden per seconde, in 28.800 seconden, maakt minimaal 8.333 DNA-polymerases.
DNA-polymerase maakt naar schatting elke honderdduizend nucleotiden één fout. Bijvoorbeeld een mismatch: een A of T tegenover een G of C. Of een breuk in een DNA-streng. Gelukkig zijn er DNA-reparatie-eiwitten die de meeste fouten opmerken en herstellen.
Om fouten zoveel mogelijk te voorkomen, zijn er allerlei momenten waarop de cel controleert of het nog wel goed gaat met de celcyclus. De belangrijkste hebben een naam gekregen, zoals het G1/S-checkpoint, dat controleert of alles klaar is voor DNA-replicatie, en het G2/M checkpoint, dat controleert of mitose kan starten. Als de schade te groot is om te repareren en ontsporing dreigt, treden processen in werking waardoor de cel zichzelf laat sterven – apoptose – of een staat van diepe slaap brengt – senescence. Ondanks alle checkpoints en veiligheidssystemen kan het nog steeds misgaan. Kanker is daarvan een voorbeeld. De cellen in een tumor houden zich niet aan de spelregels van de celcyclus, wat onder andere betekent dat ze zich onttrekken aan de checkpoints en ongehinderd kunnen doorwoekeren.
Het lichaam van een volwassen mens bevat 37 biljoen cellen (37.000.000.000.000 ofwel 3,7 × 1013)
Cellulaire veroudering
Waar apoptose een actief veiligheidssysteem is dat leidt tot een gecontroleerde celdood en -afbraak, is senescence naast een actief systeem ook een passief vangnet. Elke normale cel gaat namelijk na veertig tot zestig cycli automatisch en onomkeerbaar in senescence. Deze vangnet-variant van senescence kennen we ook wel als cellulaire veroudering. Tijdens senescence stopt de cel met delen, al blijft er wel stofwisselingsactiviteit. Na verloop van tijd wordt de senescente cel opgeruimd door het immuunsysteem. De enige gezonde cel die zich hieraan onttrekt, is de stamcel. Dit is een soort moedercel die in de embryonale ontwikkeling zorgt voor groei en later een sluimerend bestaan leidt in weefsels en in actie komt als er nieuwe cellen nodig zijn.
Verschillende processen kunnen leiden tot senescence, maar in relatie tot cellulaire veroudering zijn de zogenoemde telomeren de primaire oorzaak. Telomeren zijn de uiteinden van chromosomen en bestaan uit duizenden herhalingen van de nucleotidenvolgorde TTAGGG. Bij elke celdeling – behalve in stamcellen – gaat er een stukje van de telomeren af. Het eiwitcomplex shelterin, dat bindt aan de telomeren, moet dan steeds een stukje opschuiven, net zolang tot de telomeer zo kort is geworden dat shelterin eraf valt. Dit heeft tot gevolg dat de eerdergenoemde DNA-reperatie eiwitten het chromosoom-uiteinde ineens zien als een dubbele breuk in het DNA. Omdat er geen afgebroken DNA-streng is om vast te plakken, lukt reparatie niet en wordt de cel richting senescence gestuurd.
De telomeren zijn daarom zowel fysiek als figuurlijk te vergelijken met een lont die langzaam opbrandt, met als resultaat dat de celdeling definitief stopt.
Tien biljard celcycli
Ontsporingen zoals kanker ontstaan door mutaties in het DNA van één enkele cel. Vaak tijdens DNA-replicatie zoals we hierboven lazen, maar ook als gevolg van bijvoorbeeld uv-licht van de zon of door kankerverwekkende stoffen. Meestal gaat het om een ‘silent mutation’, wat betekent dat de mutatie zich bijvoorbeeld in een relatief onbelangrijk gebied in het DNA bevindt. Maar als zo’n foutje toevallig ontstaat in een zogenoemd tumorsuppressorgen – een gen dat codeert voor een eiwit dat op de rem trapt als er iets misgaat – zou het kunnen dat die rem niet meer werkt.
Maar ongeremd delen en ongevoeligheid voor checkpoints is niet altijd genoeg, een tumor moet vaak ook invasief kunnen groeien en kunnen ‘uitzaaien’. De kans dat al deze ‘benodigde’ mutaties samen optreden lijkt klein, maar hier geldt de wet van de grote getallen. In een tachtigjarig leven ondergaat een mens naar schatting tien biljard (10.000.000.000.000.000 ofwel 1016) celcycli, die elk meerdere mutaties introduceren die opstapelen in de tijd. Door die opstapeling zijn mutaties vroeg in het leven relatief ongunstig en komt kanker vaker voor op hogere leeftijd.
In één enkele cel zijn minimaal 8.333 DNA-polymerases tegelijk aan het werk
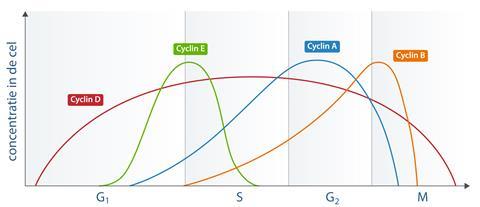
Cyclins
Wat is de drijvende kracht achter de celcyclus, die soms snel door moet gaan en soms juist helemaal niet? Daarvoor moeten we kijken naar cyclins en cyclin-dependent kinases (Cdk), twee eiwitfamilies die nauw verweven zijn met de celcyclus.
Cyclins en Cdk’s werken op veel verschillende, soms overlappende manieren. Cyclin A bijvoorbeeld zorgt ervoor dat chromosoom-verdeling tijdens metafase heel precies verloopt. Het eiwit houdt de foutcorrectie gaande zolang de chromosomen niet perfect zijn uitgelijnd in het midden van de cel. Als de concentratie cyclin A te vroeg daalt, leidt dit tot de ongelijke verdeling van chromosomen. Zolang de concentratie cyclin A daarentegen hoog blijft, zal de cel nooit uit metafase komen.
Cyclins en Cdk’s binden vaak aan elkaar en vormen zo een dimeer, waarbij de eerste zorgen voor specificiteit en de tweede voor de katalytische activiteit. Cyclin E en Cdk2 stimuleren bijvoorbeeld als dimeer de eiwitten die nodig zijn voor DNA-replicatie tijdens de progressie van G1 naar S. Een ander dimeer, namelijk van cyclin D1 en Cdk4, zet tegelijkertijd fosfaatmoleculen (PO43-) op tumorsuppressoreiwit Rb, dat zonder die fosfaatgroepen de celcyclus als een wachtpost tegenhoudt. De chemische verandering inactiveert Rb, met onmiddellijke progressie naar S-fase tot gevolg. Mutaties in het gen dat codeert voor cyclin D1 kunnen ervoor zorgen dat cyclin D1 overactief wordt en Rb permanent inactiveert, wat kan leiden tot ongeremde celdeling en dus kanker.
Aurora B kan er (niet) bij
Met al die verschillende stadia en de grote hoeveelheid spelers zijn er tal van momenten waarop het fout kan gaan bij de celdeling. ‘Error correction is daarom extreem belangrijk’, zegt Susanne Lens, hoogleraar genomische instabiliteit aan het UMC Utrecht en Oncode Investigator. ‘Tijdens het mitotische proces is een correcte chromosoomscheiding cruciaal. De zusterchromatiden moeten gebonden zien te worden aan microtubuli die afkomstig zijn van de tegenoverliggende polen van de mitotische spoel, zodat bij het daadwerkelijke splitsen van de zusters iedere dochtercel één kopie van het betreffende chromosoom krijgt.’ Gaat dat fout, dan kan het zijn dat beide zusterchromatiden naar één dochtercel worden getrokken. Dat levert een dochtercel met te veel en eentje met te weinig chromosomen - allebei onwenselijke situaties.

Eiwitcomplex
‘Wat ook gebeurt is dat één chromatide wel goed vastzit aan de mitotische spoel, maar de andere niet en die blijft dan een beetje hangen tijdens de splitsing.’ Bij het detecteren en corrigeren van dit soort fouten speelt het chromosomal passenger complex (CPC) een cruciale rol. Dit is een complex van meerdere eiwitten met Aurora B als belangrijkste speler. Aurora B is een kinase, een enzym dat eiwitten fosforyleert. ‘Het bevindt zich voornamelijk tussen de kinetochoren van de zusterchromatiden, en die kinetochoren zijn het aangrijpingspunt voor de microtubuli van de mitotische spoel’, zegt Lens. ’Aurora B fosforyleert substraten op de kinetochoren waardoor microtubuli weer makkelijk loslaten en dat levert een dynamische interactie tussen het kinetochoor en de microtubuli op die belangrijk is voor het correctiemechanisme.’
‘Wat ook gebeurt is dat één chromatide wel goed vastzit aan de mitotische spoel, maar de andere niet’
Spanning
Maar lange tijd was de vraag hoe het CPC of meer specifiek Aurora B ‘weet’ dat er goede of foutieve verbindingen zijn aangelegd. In 2009 publiceerden Lens en collega’s experimenteel bewijs voor het zogeheten spatial separation model. Fysieke afstand tussen enzym en substraat is volgens dit model een bepalende factor voor de acties van Aurora B. Lens: ‘Als de zusterchromatiden goed zijn verbonden met de microtubuli ontstaat er spanning tussen de kinetochoren door de trekkracht van de microtubuli. Daardoor wordt de afstand tussen Aurora B en substraten op het kinetochoor groter. Te groot om nog gefosforyleerd te worden.’ En dat betekent dat de correct gebonden microtubuli niet meer loslaten; de splitsing krijgt groen licht. ‘Met dit model kunnen we veel verklaren en we hebben ook experimenteel aangetoond dat die fysieke verwijdering er echt is’, zegt Lens.
Poeltjes
Toch is daarmee nog niet alles opgehelderd, zo weet ze inmiddels. ‘Voor dit model is de karateristieke lokalisatie van Aurora B tussen de twee zusterkinetochoren een allesbepalende voorwaarde. Maar toen we in 2020 Aurora B daar weghaalden, zagen we tot onze verbazing nog steeds fosforyleringsactiviteit op het kinetochoor. Het lijkt er dus op dat er verschillende poeltjes van Aurora B zijn die op iets andere plekken lokaliseren en daardoor net anders opereren, waarschijnlijk omdat ze verschillende substraten fosforyleren.’
Noodzakelijk
Dat betekent niet dat het model helemaal onderuit is gehaald, aldus Lens. ‘Nee, de bulk van Aurora B bevindt zich tussen de twee zusterkinetochoren, maar er lijkt op de kinetochoren zelf ook nog een kleine, maar actieve poel aan het werk te zijn. Blijkbaar moet Aurora B op die plek ook nog afgeschakeld worden als de juiste chromosoom-spoel connecties zijn gemaakt, maar hoe dat precies zit weten we nog niet. Wat we wel weten is dat Aurora B absoluut noodzakelijk is voor dit controlemechanisme. Want leg je Aurora B plat, dan gaat het mis.’

























Nog geen opmerkingen