Science en Nature beschouwen eiwitvouwing voorspellen met kunstmatige intelligentie als dé wetenschappelijke doorbraak van 2021. Wij spraken twee experts over de kansen en beperkingen van deze ‘gigantische stap vooruit’.
Op een dag zal het mogelijk zijn om de driedimensionale structuur van een eiwit te voorspellen enkel en alleen op basis van de aminozuurvolgorde, zo voorspelde biochemicus en eiwitstructuur-expert Christian Anfinsen in zijn dankrede voor de Nobelprijs van 1972. Bijna vijftig jaar later is het zover: ontwikkelaars slaagden er vorig jaar middels artificiële intelligentie (AI) in om eiwitvouwing bijna perfect te voorspellen.
Bepaling van eiwitstructuren vergde voorheen arbeidsintensieve analyses in het lab. Alles veranderde in juli 2021, toen het Google DeepMind-team hun AlphaFold-methode publiceerde in Nature. Kort daarna volgde het Baker-laboratorium van de University of Washington (Seattle) met hun vergelijkbare methode RoseTTAfold in Science. Beide methodes gebruiken een deep learning algoritme en kunnen relatief snel en gemakkelijk eiwitstructuren berekenen. Het DeepMind-team paste AlphaFold inmiddels toe op enkele volledige genomen, waaronder dat van de mens. Ze voorspelden de structuur van bijna elk eiwit in het menselijk lichaam en de vrijwel complete proteomen van twintig andere organismen, waaronder de muis, de fruitvlieg en bakkersgist (Saccharomyces cerevisiae).
‘Het is als het internet tot je beschikking hebben versus het boek nog moeten schrijven’
Titia Sixma
Gigantische stap
AlphaFold gebruikt vijftig jaar experimenteel verkregen structuurinformatie over eiwitten uit de PDB (Protein Data Bank) en alle beschikbare sequentiedata in diverse databanken. Het kijkt naar evolutionaire veranderingen door alle sequenties te vergelijken en te integreren met wat bekend is over structuren. Uit al die informatie samen leert AlphaFold hoe een aminozuursequentie zou kunnen opvouwen. Daarbij geeft het met kleuren en een matrix aan hoe betrouwbaar de voorspellingen zijn.
‘Het werkt geweldig!’, zegt Titia Sixma. ‘Je ziet hoe de eiwitstructuur van eiwitten die je niet gemeten hebt, zou kunnen zijn.’ Sixma is structuurbioloog bij het Nederlands Kanker Instituut (NKI) en veelvuldig gebruiker van AlphaFold. Ze onderzoekt het werkingsmechanisme van eiwitten en de signaleringsprocessen die het herstel van DNA-functies reguleren. Die informatie is onder meer van belang om effectieve medicijnen tegen kanker te ontwikkelen.

‘Wij hadden niet verwacht dat we dit in ons wetenschappelijk leven nog zouden zien’, zegt Sixma. ‘Structuurinformatie is heel nuttig en heeft vaak tot Nobelprijzen geleid, omdat het zoveel informatie geeft. AlphaFold is een gigantische stap vooruit in begrip.’ Vroeger moesten structuurbiologen jaren ploeteren – eiwit synthetiseren en zuiveren, röntgenkristallografie toepassen met complexe, dure en overvraagde apparatuur – om een eiwitstructuur in beeld te brengen, nu kunnen ze ‘gewoon even kijken’ op basis van de aminozuurvolgorde. AlphaFold laat zien waar de domeingrenzen zitten en geeft informatie over activatie als gevolg van binding op een andere plek dan in het actieve centrum, de zogenoemde allostere activatie.
‘Ze moesten nieuwe wiskunde uitvinden om de transformer functies te schrijven die deze interacties konden voorspellen’
Tassos Perrakis
Multimeren en conformatieveranderingen
Een gedeelte van de benodigde specifieke functies van de software was al bekend, namelijk het deel dat interacties voorspelt tussen aminozuren die dicht bij elkaar in de keten zitten. Deze functies zijn oorspronkelijk ontwikkeld om natuurlijke taal te verwerken: het moet groepen woorden die dicht bij elkaar staan aan elkaar linken. Dit zogenaamde ‘attention network’ probeert alle input tegelijk mee te nemen en constant uit te balanceren. ‘Het echte probleem was interacties tussen aminozuren die ver uit elkaar liggen’, zegt Anastassis (‘Tassos’) Perrakis, collega van Sixma op het NKI en werkend aan het geautomatiseerd bouwen van eiwitmodellen. ‘Daar was echt fundamentele ontwikkeling voor nodig. Ze moesten nieuwe wiskunde uitvinden om de transformer functies te schrijven die deze interacties konden voorspellen.’
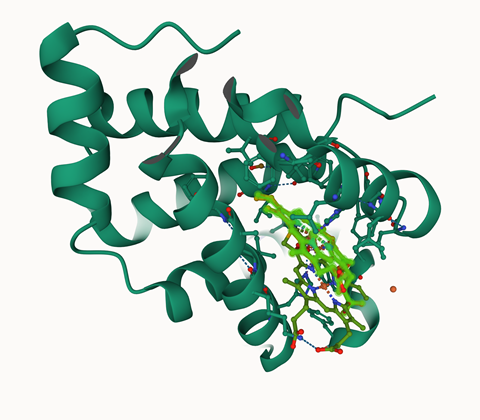
Hoewel Sixma en Perrakis enthousiast zijn over de mogelijkheden, kunnen de modellen de meeste vragen die zij als onderzoekers hebben niet beantwoorden. AlphaFold beperkt zich tot eiwitten en neemt interacties met partnereiwitten of multimeren (dimeren, trimeren, tetrameren) niet mee. Ook co-factoren, metaalionen en andere liganden blijven buiten beschouwing. Sixma: ‘Alphafold bouwt hemoglobine bijvoorbeeld op zonder heem en als monomeer. Dat bestaat in een realistische omgeving niet. De structuur is in principe correct, maar het heem ontbreekt en eigenlijk moet het een tetrameer vormen.’ Dit wordt nu deels opgelost door Alphafill, een webserver gemaakt door Perrakis en zijn onderzoeksgroep, die bekende liganden plaatst in de Alphafold modellen.
RoseTTAfold deed wel iets met multimeren en opvolger AlphaFold-Multimer kan homomere en heteromere interacties voorspellen, zij het met variabele nauwkeurigheid. Perrakis zou graag nog grotere multimeren willen bekijken. Op dit moment kun je complexen opzoeken tot een bepaalde grootte, daarna kan de grafische kaart van een computer het niet meer aan. De dataset die het eiwit beschrijft wordt dan zo groot dat de grafische kaart die hoeveelheid niet meer kan verwerken en dus ook niet om kan zetten in een afbeelding.

Voor Sixma is de belangrijkste tekortkoming dat AlphaFold maar één toestand voorspelt. Een echt eiwit ondergaat conformatieveranderingen als gevolg van bindingen met andere eiwitten, context en chemische modificaties als fosforylatie en glycosylering; de tool laat niet zien welke van de mogelijke conformaties hij voorspelt. Sixma wil eigenlijk zien hoe de werking verandert als het eiwit een conformatieverandering ondergaat. ‘AlphaFold pakt bijvoorbeeld vaak de actieve conformatie als die vaker voorkomt in de PDB.’
Daarnaast is AlphaFold niet geschikt om het effect van een puntmutatie te voorspellen. ‘AlphaFold haalt informatie uit de evolutionaire multisequence alignment. Ik zie dat mensen soms de structuur van een mutatie in de covidvariant omikron op belangrijke plekken voorspellen. Daar is het eigenlijk niet geschikt voor’, aldus Sixma. Inmiddels staan er disclaimers in de AlphaFold database. ‘Het gevaar is dat de gebruiker teveel waarde hecht aan de voorspelling.’
‘Om te begrijpen hoe het echt werkt, heb je nog steeds structuurbiologie nodig; we laten de machine alleen het saaie modelbouwwerk doen’
Titia Sixma
Kleine moleculen
AlphaFold kan vooralsnog ook geen RNA- of DNA-structuren voorspellen. Die structuren zijn minder ingewikkeld dan eiwitten en volgens Sixma kan die functie er in de toekomst bijkomen. ‘Maar het probleem met DNA is dat we veel minder informatie hebben in de PDB. Het is slechts een kleine fractie vergeleken met de bekende eiwitstructuren.’
Een andere ontbrekende functie is de binding van kleine moleculen, zoals veel medicijnen. Kleine moleculen zijn variabeler en ons begrip van die interactie met eiwitten schiet volgens Sixma echt nog tekort. ‘Die droom was er al toen ik student was. Voor eiwitvouwing hadden ze een grote informatiebron, maar binding van kleine moleculen kan nog lang duren. AI heeft altijd veel voorbeelden nodig.’ Perrakis vult aan: ‘Het grootste probleem daarbij is de onnauwkeurigheid in het plaatsen van zijketens in de huidige versie van Alphafold. Maar een update kost miljoenen euro’s. Dat is het pas waard als ze een significante verbetering kunnen realiseren.’
Biologen kunnen nu met weinig inspanning toegang krijgen tot een enorme bron aan informatie, al schuilt daar volgens Sixma ook een gevaar in. ‘Mensen denken misschien dat we geen experimenten met eiwitten meer hoeven te doen. Maar om te begrijpen hoe het echt werkt, heb je nog steeds structuurbiologie nodig. We laten de machine alleen het saaie modelbouwwerk doen. Die laat echter geen grote complexen zien, laat niet zien welke specifieke toestand wat doet, en DNA en RNA ontbreken. Die combinatie is juist interessant.’
Kristallografie blijft daarom vooralsnog belangrijk, met name voor medicijnontwikkeling en binding van kleine moleculen. Sixma, Perrakis en hun collega’s gebruiken nu vooral cryo-elektronenmicroscopie (cryo-EM) om inzicht te krijgen in hoe eiwitten werken. Ze verwacht wel dat AlphaFold een enorme boost gaat geven aan de biochemie. Voorheen moesten onderzoekers één of twee jaar wachten voor ze een vraag konden beantwoorden, nu hoeven ze alleen maar even op de computer te kijken. ‘Het is als het internet tot je beschikking hebben versus het boek nog moeten schrijven.’
Structuurbiologie
Structuurbiologie is een tak van de moleculaire biologie, biochemie en biofysica die de ruimtelijke structuur van biologische macromoleculen bestudeert, voornamelijk van eiwitten, RNA, DNA en membranen. Structuurbiologie onderzoekt hoe deze macromoleculen zich organiseren en hoe veranderingen in hun structuur de biochemische functie beïnvloeden. Biomoleculen zijn te klein om met een lichtmicroscoop te zien, vandaar dat structuurbiologen technieken zoals röntgenkristallografie, NMR en cryoEM gebruiken om structuren te bepalen.
Structuurbiologie heeft inzicht gegeven in talloze moleculaire componenten en mechanismen die een rol spelen in fysiologie en ziektes. Daarnaast is het een belangrijk gereedschap in de zoektocht naar nieuwe medicijnen.
Zuivere eiwitten
Daarin schuilt ook direct het grootste bezwaar. Eiwitkristallografen produceren veel zuiver eiwit om een structuur te bepalen. Dat is een ingewikkelde, arbeidsintensieve taak en nieuwe onderzoekers doen er een jaar over om de benodigde technieken onder de knie te krijgen. Het gezuiverde eiwit konden ze vervolgens gebruiken voor allerlei andere biochemische toepassingen. Nu de noodzaak deels wegvalt, zullen mensen wellicht de moeite niet meer nemen.
De gevolgen hiervan zijn nog niet te overzien. Sixma: ‘Een eiwit goed zuiveren is niet makkelijk. Maar als je dat niet doet, krijg je vervuilde enzymen. Arthur Kornberg (Amerikaans biochemicus die in 1959 de Nobelprijs voor Fysiologie en Geneeskunde kreeg voor de mechanismes van de biologische synthese van DNA, red.) zei: ‘Don’t waste clean thinking on dirty protein’. Als je in-vitroproeven en biochemie doet en kwantitatief wil zijn, moet je die zuivere eiwitten hebben. Als AlphaFold gaat betekenen dat mensen die niet meer maken, kan dat op sommige plekken het onderzoek beperken.’



















Nog geen opmerkingen