De intree van CRISPR/Cas heeft het genetisch aanpassen van planten ongelooflijk veel efficiënter gemaakt. Maar nog lang niet alles is begrepen en er is nog veel te verbeteren. Onder meer in Gent en Leiden buigen onderzoekers zich over de rol en inzet van DNA-reparatiemechanismen.
Het valt niet te ontkennen, CRISPR/Cas heeft de wereld van het gen-editing op z’n kop gezet. ‘Toen CRISPR/Cas op het toneel verscheen, was alles gewoon erg makkelijk’ zegt Thomas Jacobs, groepsleider van de gen-editing groep van VIB-UGent Center for Plant Systems Biology. Niet dat alle planten even makkelijk zijn aan te passen, maar het was een groot verschil met wat eerder mogelijk was. Toch zijn er ook voor het CRISPR/Cas systeem nog genoeg verbeterpunten.
Een CRISPR-experiment begint met het bepalen welk gen of genen je wilt aanpassen. Vervolgens ontwerp je een gids-RNA die het Cas enzym naar de plek van de aanpassing leidt. Daar maakt het Cas enzym een knip in het DNA waarna het DNA-reparatie systeem van de cel de breuk weer repareert. Het liefst in dit geval met een foutje erin. Door een aangepast Cas enzym te gebruiken dat niet knipt maar een extra module heeft, die bijvoorbeeld een C (cytosine) in een T (thymine) verandert, kun je individuele basen vervangen.
‘We willen dat het DNA binnenkomt, z’n functie uitoefent en dan weer verdwijnt’
Wout Boerjan, VIB-UGent Center for Plant Systems Biology
Een gen-editing experiment staat of valt met het ontwerp. Dat is precies waarom Lycka Kamoen wil weten hoe de plant z’n DNA repareert. ‘Meestal is dat foutloos’, zegt Kamoen, ‘maar het mooie van CRISPR/Cas is dat die het dan gewoon nog een keer probeert. Net zo lang totdat er een mutatie is.’
Reparatiemethode
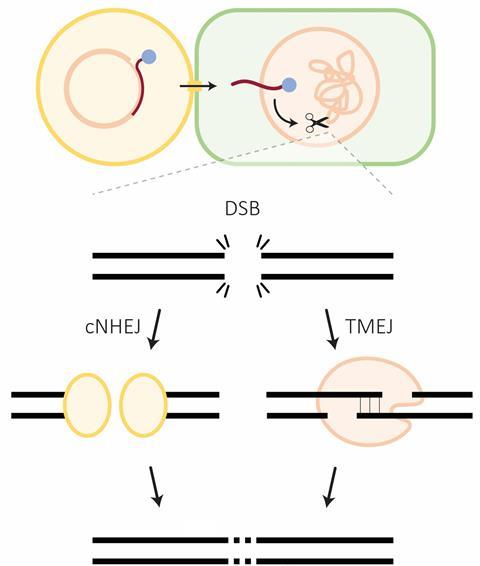
Kamoen, die als postdoc bij de Universiteit Leiden onderzoek doet naar CRISPR/Cas en DNA-reparatie, vertelt dat bij het repareren van dubbele DNA-breuken in planten twee vormen domineren: non-homologous end-joining en polymerase theta-mediated end-joining. De eerste zet, als die een foutje maakt, er een base extra bij of haalt er een tot vier vanaf. De tweede doet het per definitie niet perfect en verwijdert zo rond de 20 basen.
‘De reden hiervoor is dat polymerase theta end joining gebruikmaakt van kleine herhalingen aan weerskanten van de breuk’, zegt Kamoen. ‘Dat heet ook wel microhomologie. En in planten heb je gemiddeld genomen ongeveer drie basen nodig, dus dat is echt heel weinig.’ Omdat de herhalingen zo kort zijn komen ze overal in het genoom voor.
‘Alleen het ontwerpen van experimenten op die schaal nam al maanden in beslag’
Thomas Jacobs, VIB-UGent Center for Plant Systems Biology
De keuze van het Cas enzym lijkt weinig uit te maken voor de uitkomst van breukreparatie. Maar met het gids-RNA ontwerp kunnen onderzoekers wel sturen op de reparatiemethode die de plant inzet. Dat zit zo; normaal gesproken repareert non-homologous end joining ongeveer 70% van de breuken. Maar op het moment dat de breuk geflankeerd is door langere microhomologie gaat polymerase theta-mediated end joining de breuk vaker repareren. Kamoen: ‘Door die langere microhomologie kunnen we ook beter voorspellen hoe de mutatie eruit komt te zien, terwijl dat normaal gesproken vrij willekeurig is.’
Architectuur
De keuze van het Cas enzym hangt wel samen met het gids-RNA ontwerp. ‘Als naast de locatie van je gids-RNA toevallig geen PAM-sequentie ligt, dan werkt het niet’, zegt hoogleraar Wout Boerjan die werkt aan gen-editing in populieren bij VIB-UGent Center for Plant Systems Biology. De PAM-sequentie, die een paar basen lang is, is voor ieder Cas enzym verschillend. ‘Hoe meer Cas varianten we ontdekken, hoe gemakkelijker het wordt en hoe beter je een selectie kan maken van welke Cas te gebruiken voor welk doel’, legt Boerjan uit.
Niet alleen de gids-RNA en het specifieke Cas enzym zijn van belang voor het slagen van gen-editing, ook de architectuur van het CRISPR/Cas construct speelt mee. En dan vooral de promoters en nucleus lokalisatie signalen. ‘De architectuur waar we voor gingen was dezelfde als die men gebruikt in menselijke cellen’, zegt Jacobs. Het werkte niet alleen in de modelplant Arabidopsis, maar ook in tarwe en mais.
‘Het mooie van CRISPR/Cas is dat die het dan gewoon nog een keer probeert’
Lycka Kamoen, Universiteit Leiden
Toch bleek er ruimte voor verbetering. ‘We liepen er min of meer toevallig tegenaan’, zegt Jacobs. Hij was bezig met het testen van reporter-eiwitten met verschillende nucleus lokalisatie signalen, die de eiwitten naar de celkern sturen. ‘We waren van “Hey, deze werkt eigenlijk veel beter.” Ik vraag me af wat het met Cas9 zal doen.’ Een kleine test leidde tot een uitgebreidere test en een ontwerp dat veel efficiënter is.
Bovendien bleek ook tijdens het ontwerpen van een CRISPR/Cas experiment tijd te winnen. Doordat vaak meerdere genen een eigenschap beïnvloeden willen onderzoekers en veredelaars ook vaker meerdere aanpassingen tegelijk doen. Jacobs: ‘We merkten dat het ontwerpen van experimenten op die schaal alleen al maanden in beslag kon nemen.’ Dankzij door zijn groep ontwikkelde softwaretools, lukt dat nu in enkele minuten.
T-DNA
Wanneer het experiment eenmaal is ontworpen is het tijd voor het daadwerkelijke gen-editen. Met behulp van de bacterie Agrobacterium tumefaciens brengen de onderzoekers het CRISPR/Cas construct in de plant. Voor veel van de in het lab gebruikte planten gaat dit goed genoeg. ‘Maar bepaalde commerciële varianten zijn helemaal niet zo gemakkelijk transformeerbaar’, aldus Boerjan. Onderzoekers zoeken daarom naar alternatieven. Zoals andere A. tumefaciens stammen of virussen om gids RNA en Cas enzym in de plantencel te brengen.
Het gebruik van A. tumefaciens heeft nog een probleem: het integreert een deel van z’n DNA, het zo genoemde T-DNA, in het genoom van de plant. Iets dat voor het klassieke genetisch modificeren van planten goed van pas komt. ‘Maar voor gen-editing willen we dat het DNA binnenkomt, tijdelijk zijn functie uitoefent en dat het dan weer verdwijnt’, legt Boerjan uit.
Om dit voor elkaar te krijgen gaf zijn groep het ingebrachte DNA een extra opdracht mee in de vorm van een base-edit die de cel resistent maakt tegen herbiciden. Hiermee konden de onderzoekers cellen selecteren die geëdit zijn. Boerjan: ‘Dan heb je een reeks scheuten, die oftewel T-DNA vrij zijn, oftewel hebben ze nog altijd een T-DNA.’ Waarna de onderzoekers verder konden gaan met de T-DNA-vrije planten.
Ook Kamoen richt zich nu op T-DNA integratie in het genoom. In haar eerdere onderzoek kreeg ze hints dat polymerase theta-mediated end-joining de integratie van het T-DNA in het plantengenoom beïnvloedt. Hoe dit precies te werk gaat is ze nu aan het uitpluizen.
Ondertussen wordt bij Wageningen University & Research naar nieuwe Cas varianten gezocht. En zijn de teams in Gent bezig met onderzoek naar CRISPR-combo. Hier koppelen onderzoekers een activator aan het Cas enzym om gericht een ander gen te activeren in plaats van aan te passen. Dit kan ook een optie zijn om gericht genen te activeren die de regeneratie van plantencellen in gang te zetten.



















Nog geen opmerkingen