Onderzoekers van het UMC Utrecht en AMOLF hebben ontdekt dat twee eiwitten elkaar op eenzelfde immuuncel beïnvloeden om remmende signalen bij te sturen. Ze presenteren deze onverwachte manier waarop immuuncellen hun gedrag aanpassen in Science Signaling.
Eind vorige eeuw ontdekte immunoloog Linde Meyaard het eiwit LAIR-1, een belangrijke remmende receptor op menselijke mononucleaire witte bloedcellen. Wanneer deze wordt geactiveerd, remt het de immuunrespons om te voorkomen dat de cellen schade aanrichten. Inmiddels treedt de receptor daarom steeds meer naar voren als een belangrijk therapeutisch doelwit voor de bestrijding van kanker.
Met haar groep aan het UMC Utrecht graaft Meyaard nog steeds in de precieze werking van LAIR-1. Daarbij was de verwachting dat de activiteit van de receptor voornamelijk zou afhangen van diens expressie. Nu hebben de onderzoekers, samen met het team van biofysicus Kristina Ganzinger van AMOLF, ontdekt dat het anders ligt. Het eiwit MARCO, aanwezig aan het oppervlak van sommige immuuncellen, kan binden aan LAIR-1 wanneer beiden op dezelfde cel zitten – een zogeheten cis-interactie. Meyaard: ‘MARCO bindt op dezelfde manier aan deze receptor als het ligand van LAIR-1, collageen. Om die reden gingen we ervan uit dat MARCO LAIR-1 zou activeren.’ Immunoloog Saskia Vijver, gedeeld eerste auteur van het onderzoek, vult aan: ‘Wat daarom geheel onverwacht was, is dat MARCO de werking van LAIR-1 juist belemmert. Deze cis-interactie, met regulatie op dezelfde cel, is niet eerder gezien bij dit soort receptoren.’
Rem op de rem
Voor de onderzoekers tot deze ontdekking kwamen, bestudeerden ze de trans-interactie tussen MARCO en LAIR-1. Hiervoor brachten ze de eiwitten afzonderlijk tot expressie op aparte immuuncellen. Bij het samenkomen van de twee zagen ze hoe MARCO de werking van LAIR-1 stimuleerde. ‘Maar toen we in gegevensbanken gingen zoeken waar de eiwitten in het lichaam tot expressie komen op cellen, ontdekten we dat MARCO voornamelijk voorkomt op cellen waar ook LAIR-1 al aanwezig is’, zegt Meyaard. ‘Onze in vitro studie weerspiegelde dus maar een deel van de realiteit. Daarnaast zagen we dat tumoren een grotere hoeveelheid cellen hebben waarop beide eiwitten tot expressie komen.’
Daarom besloten de onderzoekers deze tumor-geassocieerde macrofagen in vitro te bestuderen. Meyaard: ‘We ontdekten dat als MARCO op dezelfde cel als LAIR-1 voorkomt, dit niet een remmend signaal veroorzaakt, maar dat dit juist het remmende signaal door de oorspronkelijke ligand voorkomt.’
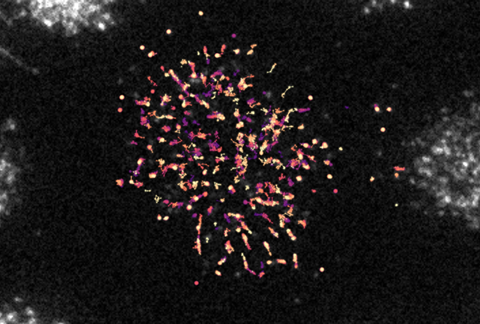
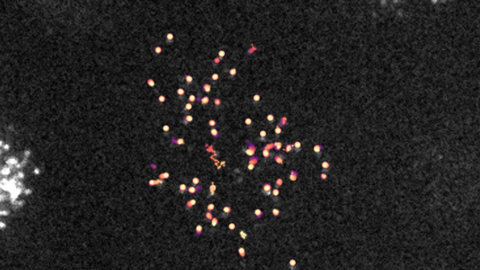
Beweging bekijken
Om deze interactie in beeld te brengen, werkten de onderzoekers van UMC Utrecht samen met Ganzingers groep van AMOLF. Met geavanceerde microscopietechnieken en tracking software wisten zij MARCO en LAIR-1 als individuele eiwitten over het oppervlak van de cel te volgen. ‘Hiervoor labelden we beide eiwitten met verschillende fluorescente markers’, zegt Ganzinger. ‘Door met onze microscoop in te zoomen op het plasmamembraan van de cel, konden we zo beide fluorescente receptoren en hun afzonderlijke bewegingen volgen.’
Zo ontdekten de onderzoekers dat MARCO erg traag rond beweegt en LAIR-1, wanneer deze alleenstaand voorkomt op een cel, juist heel snel. Ganzinger: ‘Maar als beiden tot expressie komen op dezelfde cel, zagen we dat LAIR-1 net zo traag beweegt als MARCO, wat op een directe moleculaire interactie duidt. Toen we vervolgens antilichamen gebruikten om deze binding te blokkeren, versnelde LAIR-1 weer.’
Nieuwe weg
De ontdekking biedt inzichten in hoe immuuncellen zichzelf reguleren. In plaats van alleen afhankelijk te zijn van signalen van buitenaf, laat de werking van MARCO zien hoe immuuncellen ook zelf beïnvloeden wanneer ze op de rem trappen. Begrijpen hoe deze interacties precies in hun werk gaan, is dan ook van groot belang voor de ontwikkeling van immunotherapieën tegen kanker.
Inmiddels hebben de onderzoekers nog een andere bindingspartner voor LAIR-1 ontdekt die op dezelfde cel voorkomt. Daarbij lijkt het voorlopig dat het juist LAIR-1 is die deze andere receptor blokkeert. Op zoek naar de precieze werking van deze interacties blijft de samenwerking tussen UMC Utrecht en AMOLF doorzetten. Meyaard: ‘Dat dit soort cis-interacties zo bepalend kan zijn, is voor mij een openbaring. Ineens ligt zelfregulatie van cellen door dit soort receptoren op tafel. Dat opent een geheel nieuwe weg voor het onderzoeksveld.’
Singh, A. et al. (2025) Science Signaling 18(916), DOI: 10.1126/scisignal.ado2768



















1 Opmerking van een lezer