Radiochemicus Erik de Blois deinsde niet terug voor de grote technische uitdagingen van werken met een α-straler in een klinische omgeving onder GMP-condities, wat resulteerde in het eerste fase 1-onderzoek met een radioactief medicijn. ‘Ik ben nu eenmaal praktisch ingesteld.’
Eén ding is duidelijk na een gesprek met dr. Erik de Blois, klinisch radiochemicus en hoofd kwaliteitscontrole aan het Erasmus MC: zijn team moest zo’n beetje alles zelf uitvinden voor de ontwikkeling van hun nieuwe medicijn tegen prostaatkanker, gebaseerd op een radioactieve actinium-isotoop. ‘We begonnen vrijwel op nul’, zegt hij.
De Blois schetst de uitdagingen die hij en zijn team voor de kiezen kregen. Van de verkrijgbaarheid en zuivering van actinium en de koppeling ervan aan een biologisch actief molecuul, tot de strikte wetgeving voor werken met α-stralers en de dunnelaagchromatografie en HPLC-technieken die hij moest ontwikkelen om iets te kunnen zeggen over de opbrengst en zuiverheid. En voor een fase 1-studie moest het ook allemaal onder GMP-condities. ‘Ik wilde dit al langer maar had geen idee waar ik moest beginnen, zoveel technische uitdagingen waren er’, zegt hij met een lach.

Kernafval en kernwapens
Hoe kom je bijvoorbeeld aan Ac-225? Dat blijkt een verhaal op zich. ‘Actinium komt alleen voor als radioactieve isotoop en is supergiftig’, vertelt De Blois. ‘Het wordt nog bijna nergens gebruikt, er zijn nauwelijks leveranciers en er bestaan nog geen GMP-protocollen voor productie.’
De meest gangbare bronnen blijken kernafval en afgedankte kernwapens, waar je voorloper thorium-229 uit haalt. Dat is radioactief met een halfwaardetijd van 7.430 jaar. Je bindt het op een kolom, elueert het, en dan komt er radium-225 vrij, wat weer vervalt naar Ac-225. De Blois noemt deze opstelling een ‘melkkoe’ voor de productie van Ac-225; deze melkkoe staat in het JRC Karlsruhe (Duitsland), onderdeel van het Joint Research Center en het Directorate for Nuclear Safety and Security van de Europese Commissie.
‘Het zou best kunnen dat veel collega’s de kansen voor deze methode ook wel zagen, maar hun vingers niet durfden te branden aan de technische uitdagingen’
Actinium straalt α-deeltjes uit: twee protonen en twee neutronen. ‘Deze α-deeltjes zijn ideaal voor dit type therapie’, zegt De Blois. ‘Het geeft door de hoge energie relatief veel schade, maar op heel korte afstand.’ Het is daarom van groot belang dat het precies in de tumorcellen terechtkomt en snel weer weg is als het daar niet zit. Het niet-gebonden Ac-225-PSMA zit binnen twaalf uur voor zo’n 70% in de urine, waar het weinig tot geen schade toebrengt. Daarnaast heeft het PSMA gebonden aan de prostaattumorcellen een biologische halfwaardetijd van ongeveer twee dagen, dat wil zeggen dat het lichaam na twee dagen de helft van het Ac-225-PSMA kwijt is.
Een paar femtomol
Wat volgens De Blois een paar jaar heeft geduurd om onder de knie te krijgen, zijn de stappen voor kwaliteitsbewaking: zuivering, aantonen dat het product gebonden is aan de chelator, dat het productieprotocol voldoende consistent is, en dat het ook in voldoende werkzame concentratie in de prostaatkankercellen aankomt. En dat elke keer als je het gaat toedienen. De Blois: ‘Het was ontzettend lastig. We hebben het over een paar femtomol van een materiaal dat al heel moeilijk te meten is, omdat het zich makkelijk laat tegenhouden, al door een papiertje. Maar francium-221 is een vervalproduct van Ac-225 en dat zendt γ-straling (een foton, red.) uit met een energie van 218 keV, ruim binnen een gangbaar meetbereik. En dat is representatief voor de aanwezige hoeveelheid Ac-225.’
‘Er is nog maar weinig bekend over Ac-225 in een farmacologische setting’
Een bijkomend probleem vormt de hoge energie die vrijkomt bij het eerste verval van Ac-225. ‘Dat proces heet recoil en betekent dat het actiniumatoom uit de chelator wordt geduwd, waarmee de chemische eigenschappen veranderen’, zegt De Blois. ‘Dus moeten we eerst dunnelaagchromatografie doen om de gebonden actiniumfractie te scheiden van de door recoil vrijgekomen fractie en van de eventuele vrije fractie Ac-225, zodat we iets kunnen zeggen over de hoeveelheid daadwerkelijk werkzaam medicijn.’
De schade die de α-deeltjes aanrichten aan de DOTA-chelator en aan PSMA zorgen ervoor dat het product maar drie uur houdbaar is, zelfs in aanwezigheid van quenchers en radicalenvangers als vitamine C, gentisinezuur en ethanol.
Pionieren
‘We hebben toestemming om aan een fase-1-studie te beginnen, geholpen door een KWF-subsidie’, vertelt De Blois. ‘Een belangrijk onderdeel daarvan is een dosis-escalatiestudie, waarbij we laag beginnen en de dosis langzaam opvoeren. De eerste patiënten hebben we al geselecteerd en krijgen medio februari hun behandeling.’ Die patiënten zijn een vrij goed gedefinieerde groep: uitbehandelde prostaatkankerpatiënten van wie de prostaat is verwijderd, maar met uitzaaiingen. In Duitsland zijn enkele casestudies – niet gereguleerd volgens fase 1 en 2 – bekend van een vergelijkbare techniek en daarmee zijn volgens De Blois ‘heel veelbelovende resultaten’ geboekt. ‘Sommige mensen waren na drie maanden helemaal schoon.’
De GMP-behandeltechniek is vorig jaar gepubliceerd in Pharmaceutics, met De Blois’ promovendus Eline Hooijman als eerste auteur. Er is wereldwijd veel aandacht voor hun werk, zelfs van het International Atomic Energy Agency, want het is ‘echt pionieren’, zegt hij. ‘Ik zit inmiddels 22 jaar in deze wereld en ik ken de meeste collega’s wel zo’n beetje, want de radiochemie is niet zo’n groot veld. Het zou best kunnen dat veel collega’s de kansen voor deze methode ook wel zagen, maar hun vingers niet durfden te branden aan de technische uitdagingen.’
‘We werken inmiddels aan meerdere compounds die we labelen met Ac-225’
Hij zag daar juist de lol van in en werd daarbij geholpen door zijn achtergrond. De Blois startte zijn carrière namelijk aan het MLO en werkte zich via avonduren-HLO op naar een universitaire master drug innovation en uiteindelijk een promotie als radiochemicus. ‘Ik ben nu eenmaal praktisch ingesteld en dat helpt erg bij de implementatie van dit soort technische vraagstukken. Maar ik doe het natuurlijk niet alleen, het team heeft geweldig werk geleverd. Pionieren doen we samen.’
En de toekomst is rooskleurig, denkt De Blois. ‘We werken inmiddels aan meerdere compounds die we labelen met Ac-225 en er is een tweede KWF-subsidie toegekend. Het balletje is dus flink aan het rollen.’
Ac-225-PSMA
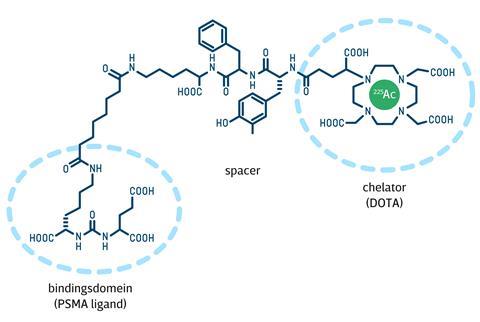
Het nieuwe medicijn Ac-225-PSMA is een slim gebouwd complex van een eiwit dat specifiek naar de prostaat gaat en een DOTA-chelator [(CH2CH2NCH2CO2H)4; een soort kooiconstructie die metaalionen kan invangen] met daarin een α-straler, namelijk actinium-225 (Ac-225). Een spacer-molecuul verbindt het eiwit en de chelator. Het gebruikte eiwit is een bekende ligand van PSMA (prostate-specific membrane antigen), een transmembraaneiwit dat alleen in de prostaat voorkomt en sterk is verhoogd in prostaattumorcellen. Een injectie met Ac-225-PSMA wordt in korte tijd – het meeste binnen een uur, dan nog gedurende ongeveer drie tot vier uur – vooral in prostaattumorcellen opgenomen, waar het radioactieve Ac-225 vervalt (de halfwaardetijd is ongeveer tien dagen) naar uiteindelijk de stabiele isotoop bismut-209. Daarbij vuurt het bundeltjes van twee protonen en twee neutronen (een α-deeltje) af op de tumor.





















Nog geen opmerkingen