Bekijken hoe bicarbonaat een membraan doorkruist kan tot nu toe alleen indirect aan de hand van chloride-ionen of water. Maar Hennie Valkenier en haar groep ontwikkelde een assay waarbij je bicarbonaattransport direct kunt waarnemen met behulp van een europiumcomplex.
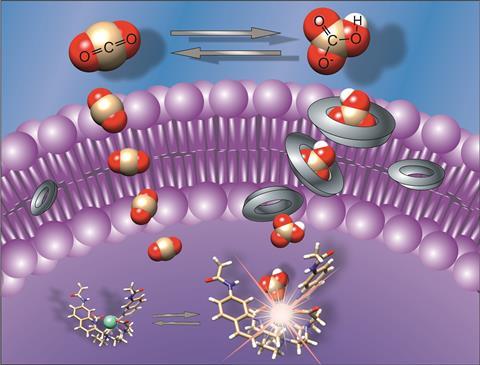
Bicarbonaat is in de biologie een levensbelangrijk anion. Maar in tegenstelling tot bijvoorbeeld chloride is het transport van bicarbonaat door het celmembraan heen veel moeilijker te onderzoeken. ‘In onze cellen transporteren transmembraaneiwitten bicarbonaat de cel in en uit’, vertelt Hennie Valkenier, onderzoeker voor de Fondation Nationale de la Recherche Scientifique aan de Université libre de Bruxelles. ‘Maar hoe die precies werken, is lastig te bepalen vanwege de complexiteit van de cel.’
Omdat transmembraantransport ook een rol speelt bij verschillende ziektes, waaronder bijvoorbeeld taaislijmziekte (cystic fibrosis, CF), is het belangrijk om het transport van bicarbonaat te kunnen onderzoeken. Dat doet de groep van Valkenier met zelfgemaakte transporters, kleine moleculen (carriers of anionoforen) die zich in een lipide bilaag kunnen verschansen. ‘Waar je je een transmembraan-transporteiwit kunt voorstellen als een tunnel door de celmembraan heen, zijn onze carriers meer een soort veerpontjes die bicarbonaationen de cel in of uit vervoeren’, legt Valkenier uit. Maar de carriers zijn pas de eerste stap. Want hoe detecteer je dat transport? Daarover publiceerden Valkenier, Steve Butler en collega’s in Chemistry – A European Journal.

Rood-oranje licht
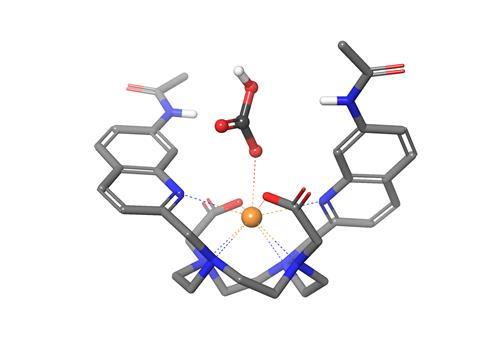
‘De detectie gebeurt met een europiumcomplex, dat in het lab van Steve Butler is ontworpen om fluoride-ionen te detecteren’, licht Valkenier toe. ‘Het interessante aan dit complex is, dat wanneer het bicarbonaat bindt, het complex licht met een rood-oranje kleur uitzendt.’ In het fluorescentiespectrum krijg je niet zomaar één brede piek, maar meerdere smalle pieken die karakteristiek zijn voor lanthaniden, door de vele elektronen in hun buitenste schillen. Het complex, [Eu.L1]+, heeft daarnaast alleen verwaarloosbare interacties met NO3- en Cl- ionen, waardoor je echt kunt focussen op het bicarbonaattransport.
Het assay werkt als volgt: in een oplossing van [Eu.L1]+ omhul je het complex met de vetmoleculen POPC (een fosfatidylcholine) en cholesterol, waardoor liposomen vormen. Als je die liposomen vervolgens door een zeef perst, krijgen ze een gemiddelde diameter van ongeveer 200 nm. Zowel binnen als buiten de liposomen bevindt zich een buffer van NaCl, en een van de anionoforen integreer je in de membranen van de liposomen. Als laatste voeg je er een oplossing van NaHCO3 aan toe. Wanneer het bicarbonaat vervolgens het binnenste van de liposomen bereikt, zie je de lichtintensiteit van het europiumcomplex toenemen.
‘Bicarbonaat leek door sommige kationoforen getransporteerd te worden, terwijl dat helemaal niet kan’
Het meest verrassende was nog wel dat het transportmechanisme van een aantal anionoforen anders was dan gedacht. Valkenier: ‘Doordat we nu alleen bicarbonaattransport maten, leken sommige moleculen bicarbonaat te vervoeren die dat normaal niet doen. We deden toen tests met kationoforen, en jawel: bicarbonaat leek ook door sommige kationoforen getransporteerd te worden, terwijl dat helemaal niet kan!’ Wat was nu het geval: bicarbonaat bevindt zich in evenwicht met koolstofdioxide, en koolstofdioxide kan diffunderen door het membraan heen, waarna het met een watermolecuul kan reageren tot protonen en bicarbonaat, wat uiteindelijk bindt aan [Eu.L1]+ en een signaal afgeeft. Dit proces kan dus ook plaatsvinden als een ionofoor protonen transporteert.
‘Later kwamen we erachter dat dit eigenlijk heel normaal gedrag is in de biologie’, geeft Valkenier toe. ‘Wel hebben we nu zekerheid dat een van de anionoforen echt alleen bicarbonaat transporteert. Maar onze resultaten lijken ook aan te geven dat sommige gerapporteerde bicarbonaattransporters eigenlijk geen bicarbonaat vervoeren, maar eerder de pH stabiliseren wanneer CO2 diffundeert.’
Cellen om zeep helpen
Naast de fundamentele inzichten die Valkenier en collega’s met dit onderzoek wonnen, is ze ook optimistisch over de ontwikkeling van dit onderzoeksgebied. ‘Transmembraantransport is in de afgelopen twintig jaar flink gegroeid als wetenschap, en ik verwacht in de komende twintig jaar echt wel praktische toepassingen.’
‘Ik verwacht de komende twintig jaar toepassingen voor transmembraantransporters’
Valkenier droomt er bijvoorbeeld van om de carriers uit haar groep in te zetten tegen taaislijmziekte, waar de natuurlijke eiwitten het laten afweten. ‘Zo zijn er nog allerlei andere ziektes die weer aan andere anionentransporters zijn gekoppeld’, zegt ze. ‘Het is alleen heel moeilijk om iets wat in de cel kapot is weer heel te maken.’
Makkelijker is het dood maken van cellen. Valkenier: ‘De homeostase tussen anionen is heel belangrijk voor cellen, dus als je die verstoort, kun je bijvoorbeeld bacteriën of kankercellen makkelijk om zeep helpen.’ Ze verwacht op korte termijn toepassingen te zien in de antibiotica en antikankermiddelen. ‘Bij bicarbonaattransport specifiek zou je ook kunnen kijken naar planten om fotosynthese efficiënter te maken. Of wat dacht je van het maken van een artificiële cel? Daarvoor heb je ofwel transporteiwitten, ofwel carriers voor nodig. We zijn in ieder geval nog lang niet uitgeleerd.’
Martínez-Crespo, L. et al. (2022) Chem Eur J 27(26), https://doi.org/10.1002/chem.202100491




















Nog geen opmerkingen