Eiwitten en hun katalytische versies, enzymen, bezitten vaak een enorm complexe structuur. Daardoor is er eigenlijk geen beginnen aan om ze doelgericht te gaan aanpassen. Een nieuwe techniek brengt daar plots verandering in.
Enzymen danken hun specificiteit voor een belangrijk deel aan hun welbepaalde driedimensionale structuur. Die is in de loop van de natuurlijke evolutie, via vele mutaties, ontstaan. Deze structurele mutaties zijn dus vaak ook functioneel gebleken. Scheikundigen willen zulke structureel-functionele mutaties ook doelgericht kunnen aanbrengen in eiwitten, zodat die inzetbaar zijn als enzymen in de (bio)organische chemie.
Het herprogrammeren van eiwitten is echter nog voor een groot stuk nattevingerwerk, want chemici weten gewoonlijk niet waar te beginnen om de juiste veranderingen in de eiwitstructuur aan te brengen met het gewenste effect op de functionaliteit. De ruimtelijke structuur van eiwitten is doorgaans zeer complex en mede daardoor vaak niet eens gekend. Omdat de meeste eiwitten opgebouwd zijn uit (vele) honderden aaneengeklonken aminozuren, is het aantal mogelijke structuren waaruit ze kunnen bestaan – en dus het aantal structuren waarin ze via mutaties kunnen vervormen – nauwelijks uit te drukken in een gewoon getal. Om al die vormen van gemuteerde eiwitten een voor een te bewerkstelligen en functioneel te testen, daar is gewoonweg geen tijd voor.
Vertrouwde techniek
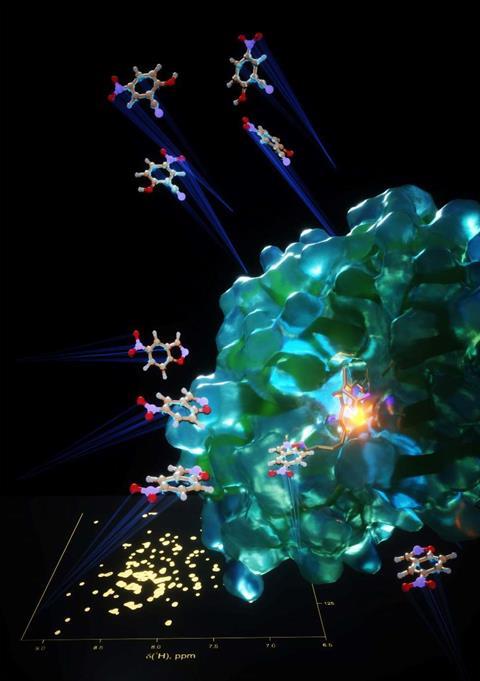
En dus wordt gezocht naar manieren om de functionaliteit van eiwitten niet te gaan uitproberen, maar voorspellen. Dat kan via simulaties van mutaties, maar helaas is daar vaak a priori informatie over de eiwitstructuur voor nodig. Het kan ook met een techniek waarmee chemici al heel vertrouwd zijn: NMR-spectroscopie. Vorig jaar oktober publiceerde een internationaal team in het vakblad Nature een methode waarbij NMR binnen eiwitten ‘mutagene hotspots’ aan het licht kan brengen. Dat zijn plekken waar veranderingen in de structuur leiden tot een andere, gewenste functionaliteit.
Het bijzondere is dat de structuur daarvoor zelfs niet bekend hoeft te zijn, de eiwitten in kwestie moeten alleen in contact worden gebracht met het beoogde substraat. De hotspots komen aan het licht door de sterke NMR-signalen die de atomen en atoomgroepen er produceerden. De tijdwinst door deze nieuwe vorm van zogeheten gestuurde eiwitevolutie is gigantisch. ‘We kunnen de mogelijke mutagene plekken in de eiwitten en de mogelijke variaties beperken tot een tiental’, duidt Alexander Volkov, vorser aan de Vrije Universiteit Brussel en medeauteur van het Nature-artikel. ‘Zo kunnen we heel snel de functionele eigenschappen van eiwitten aanpassen in de gewenste richting.’
Kemp-eliminatie
Het team demonstreerde de nieuwe techniek door het niet-katalytische eiwit myoglobine te muteren naar een katalysator voor de Kemp-eliminatie; een reactie waarbij een proton wordt onttrokken aan een koolstofatoom. Daar waren slechts drie mutaties in het myoglobine-eiwit voor nodig, en het was dankzij NMR-spectroscopie dat de vorsers wisten waar in de eiwitstructuur ze die moesten aanbrengen. Al behelsde dat wel meerdere stappen, want initieel verraadde de eiwitspectroscopie vijftien potentieel relevante hotspots om te komen tot een Kemp-eliminase. Uiteindelijk bleken drie hotspots een prima combinatie te vormen: samen zorgden ze voor een enzym dat twee ordes van grootte krachtiger is dan eerder in het lab gefabriceerde enzymen voor de Kemp-reactie.
‘Zo kunnen we heel snel de functionele eigenschappen van eiwitten aanpassen’
Elegant
De NMR-techniek opent perspectieven naar een snellere en efficiëntere eiwitengineering. Goede timing, want nieuwe of verbeterde enzymen zijn hoogst welkom in verschillende sectoren. Ze kunnen reacties helpen vergroenen door ze bijvoorbeeld zuiniger met energie of solventen te maken, en ook goedkoper. Natuurlijk is de nieuwe techniek ook potentieel interessant voor de farmaceutische industrie, waar de productie van complexe moleculen die de werkzame stof van medicijnen vormen vaak veel energie, tijd en geld kost.
Het grote voordeel van de nieuwe techniek is dat kennis over de structuur van de basiseiwitten geen vereiste is. Daarnaast is deze methode, althans voor chemici vertrouwd met biochemie, betrekkelijk eenvoudig. Zo heeft menig labo wel een NMR-installatie in huis. ‘Het maakt onze techniek om eiwitten gericht te muteren via NMR-spectroscopie dus heel toegankelijk’, aldus Volkov.
Een nadeel van de techniek is wel dat ze voorlopig enkel werkt bij relatief kleine eiwitten, zegt Arnout Voet, biochemicus aan de KU Leuven en onder meer gespecialiseerd in eiwitengineering (en zelf niet betrokken bij het Nature-onderzoek). ‘Biokatalysatoren hebben vaak veel meer dan tweehonderd aminozuren. Boven die drempel wordt het moeilijk om de verschillende NMR-signalen die de eiwitstructuur afgeeft, nog te kunnen onderscheiden.’ De onderzoekers onderkennen dat manco, al doet het voorlopig niks af aan de potentie van hun techniek bij relatief kleine eiwitten – zoals myoglobine dus, dat ‘slechts’ bestaat uit 153 aminozuren. ‘Hiervoor is het een relatief eenvoudige en bijzonder elegante techniek. Zaak is om ze uit te breiden na naar grotere eiwitten’, aldus Voet.















Nog geen opmerkingen