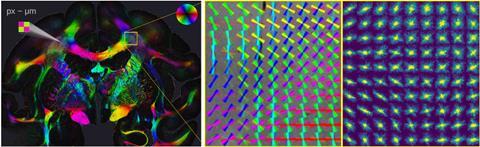
De hersenen bevatten miljoenen zenuwvezels die dicht op elkaar gepakt zijn, waardoor het lastig is om de vezels van elkaar te onderscheiden met microscopische technieken. Miriam Menzel ontwikkelde een eenvoudige lichtmicroscopietechniek die de oriëntatie van deze vezels in beeld kan brengen.
Miriam Menzel was eigenlijk helemaal niet van plan om een nieuwe imagingtechniek uit te vinden. Ze heeft een achtergrond in theoretische natuurkunde en deed haar promotieonderzoek en postdoc aan het Forschungszentrum Jülich in Duitsland. Daar deed ze simulaties en modellering van lichtvoortplanting door weefsels heen. Haar collega’s gebruikten polarisatiemicroscopie om naar het zenuwvezelnetwerk in hersenen te kijken, maar hiermee konden ze de vezels in sterk verweven netwerken niet van elkaar onderscheiden. De oriëntatie van kruisende vezels bleef met deze techniek namelijk onzichtbaar. Wat bleek? De patronen van lichtverstrooiing in Menzel’s simulaties lieten wél zien hoe deze vezels georiënteerd waren.

Tijdens haar postdoc verlegde ze haar focus naar de experimentele kant. Ze bezocht TU Delft, haar huidige werkgever, omdat zij een geschikte laserproefopstelling hadden waarmee ze de bevindingen uit haar simulaties kon valideren. Toen dat werkte, ging ze de strooitechniek toepassen op verweven zenuwvezels.
De hersenen bevatten miljoenen zenuwvezels die dicht op elkaar gepakt zijn en waarin zelfs kleine zenuwbanen een verschil kunnen maken in het functioneren van de hersenen. Voor bijvoorbeeld het bestuderen van neurodegeneratieve ziekten zoals Alzheimer heb je een uiterst precies model nodig. De technieken die reeds beschikbaar waren, konden de individuele oriëntaties van dicht opeengepakte, in elkaar verweven vezels niet voldoende reconstrueren. Elektronenmicroscopie duurt te lang voor grote volumes, diffusie-MRI geeft te lage resolutie en met polarisatiemicroscopie kun je de vezels niet van elkaar onderscheiden als ze elkaar kruisen, wat leidt tot een verkeerde reconstructie van de zenuwvezelbanen en verbindingen.
Simpele lichtbron
De techniek die Menzel ontwikkelde, genaamd ‘computational scattered light imaging’ of kortweg ‘scattered light imaging’ (SLI), is makkelijk op te zetten. Je kunt een simpele lichtbron gebruiken, zoals een led, en het is veel sneller en toegankelijker dan röntgenverstrooiing. Dat laatste laat ook zien wat de oriëntatie van kruisende vezels is, maar de straal waarmee je belicht is klein en voor hoge resolutie heb je veel datapunten nodig en kost dus veel geld. Menzels techniek behaalt in minder dan een minuut resultaten en geeft informatie over het gehele beeldveld van de weefselplak. Daarnaast is het compatibel met verschillende samplepreparaties.
‘Veel zenuwvezels hebben een isolerende mantel’, legt Menzel uit. ’Röntgenstraling wordt verstrooid door de vele lagen van deze mantel. Onze techniek functioneert puur op de oriëntatie van vezelbundels en werkt ook als deze mantel kapot of niet aanwezig is. Dat is een groot voordeel als je met neurodegeneratieve hersenen werkt of met samples die op verschillende manieren geprepareerd zijn.’ Een voordeel ten opzichte van MRI is de hoge resolutie, maar Menzel benadrukt dat hun techniek MRI niet kan vervangen. ‘Dat werkt op complete levende hersenen, wij kijken hier alleen naar dode samples.’
‘Onze techniek functioneert puur op de oriëntatie van vezelbundels’
Transparante plak
Het principe van SLI is vrij simpel, zegt Menzel. ‘We hebben een weefselplakje dat transparant genoeg is, daar schijnen we ons licht doorheen onder een bepaalde hoek. De lamp blijft onder die hoek staan en beweegt in een cirkel waarbij die het monster van alle kanten belicht. Aan de andere kant van het weefselplakje meten we met een camera wat er loodrecht doorheen schijnt tijdens de beweging van de lichtbron. We meten dus verstrooid licht. Het is als het ware een omkering van röntgenverstrooiing. De lichtbron is groter en je verliest resolutie in het frequentiedomein, maar wint resolutie in het ruimtedomein.’
De resulterende serie foto’s moet je vervolgens nog analyseren met een speciaal algoritme om de vezelrichtingen te reconstrueren. Dat analyseren bleek de lastigste klus. Als de lichtbron niet fel genoeg is en er niet genoeg licht door het weefselplakje valt, heb je wellicht teveel ruis. Nadat Menzels team het algoritme had ontwikkeld, kon ze haar techniek vergelijken met bestaande technieken zoals röntgenverstrooiing en diffusie-MRI. Ze publiceerde de resultaten in mei 2023 in eLife, in samenwerking met collega’s in Stanford en Jülich.
Inmiddels is Menzel universitair docent aan de TU Delft op de afdeling Imaging Physics. De volgende stap is naar licht kijken dat van het sample terug verstrooid. Dan zou het sample niet meer zo dun hoeven zijn dat het doorzichtig is. ‘Dat signaal is dan veel kleiner en daardoor is de analyse nog lastiger, maar we zouden ons sample niet meer hoeven snijden en kunnen oppervlakken onderzoeken op een niet-invasieve manier.’ Ze denkt dat haar techniek een toevoeging kan zijn aan een standaardmicroscoop. Zelf zou ze het ook op andere soorten weefsels willen toepassen, zoals spiervezels en kankerweefsels in verschillende stadia, zodat ze kan zien hoe de vezelstructuur verandert. ‘Klinische toepassingen zijn een belangrijk doel voor mij. Onze techniek is biologisch veilig en ik zie groot potentieel in de niet-invasieve diagnostiek.’





















Nog geen opmerkingen