Ook geoxideerde metalen lijken een actieve rol als katalysator voor CO2-omzetting op zich te kunnen nemen, in tegenstelling tot wat wetenschappers tot nu dachten, melden Utrechtse onderzoekers in Nature Communications.
CO2 efficiënt omzetten in brandstoffen is al lange tijd een uitdaging. Meestal gebruik je dan metallische katalysatoren, bijvoorbeeld nikkel, palladium of platina, maar in de afgelopen jaren is duidelijk geworden dat niet alleen metallisch kobalt (Co) hier een goede kandidaat voor is, maar ook zijn geoxideerde vorm (CoO). Iris ten Have, Bert Weckhuysen en collega’s laten nu zien hoe het reactiemechanisme werkt en dat CoO zelfs beter presteert dan Co.
Kobalt kan van zichzelf vrij effectief koolstofverbindingen katalyseren, zichtbaar in de Fischer-Tropsch synthese (FTS) waarbij je CO en H2 omzet in korte koolwaterstofketens. De onderzoekers keken naar een vergelijkbaar proces waarin je het bijna inerte CO2 met nanodeeltjes (in dit geval ±10 nm) omzet. Bij dit proces bepalen ook de oxidatietoestand van kobalt, de kobaltfase, en het support-oxide mede de effectiviteit van de omzetting. In dit geval speelden ze vooral met reduceerbare (TiO2 en CeO2) en niet-reduceerbare (SiO2 en Al2O3) metaaloxidesupports en dus ook de kobalt-oxidatietoestand.
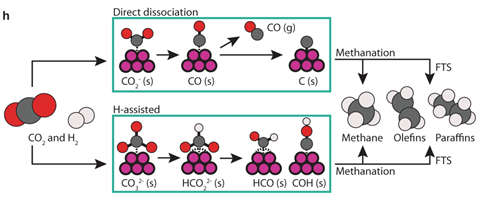
In de hydrogeneringsreactie van CO2 met kobalt begint de omzetting met de zogeheten reverse water-gas-shift, die op twee manieren kan starten afhankelijk van je katalysator. Ofwel de direct dissociation pathway, ofwel de hydrogen-assisted pathway. De effecten van de eerder genoemde variabelen onderzochten de onderzoekers met ME DRIFTS. Daaruit bleek dat metallisch Co de reactie via het dissociation pathway katalyseerde, terwijl CoO de H-assisted pathway koos (zie de afbeelding).
De beste katalysator/support-combinatie bleek CoO/TiO2 te zijn, en door een beetje CO toe te voegen aan de CO2 in de verhouding 1:2 ging de selectiviteit voor koolwaterstoffen langer dan twee C-atomen (C2+) omhoog van 11 naar 39%. Dat zorgde uiteindelijk voor een totale C2+-opbrengst van 104 mmol∙h-1∙gcat-1 bij industriële condities.
Niet alleen is dit een interessante vinding voor de omzet van CO2 naar langere koolwaterstoffen, ook op fundamenteel vlak is dit een boeiende ontdekking. In de conclusie noemen de auteurs de ontdekking ‘een paradigmashift in de klassieke visie op de katalytische actieve fase’, want blijkbaar kunnen geoxideerde metalen ook prima reacties katalyseren. Praktisch gezien is het reduceren van katalysatoren (dat bij hoge temperaturen gebeurt) daarom misschien niet altijd nodig, omdat de geoxideerde toestand misschien nog wel beter werkt dan de gereduceerde. Het nodigt in ieder geval uit om huidige katalytische processen nog eens onder de loep te nemen.
Ten Have, I.C. et al. (2022) Nat. Commun. 13(324)















Nog geen opmerkingen