Sinds de uitbraak van de SARS-CoV-2-pandemie is mRNA zo’n beetje het bekendste macromolecuul ter wereld. Iedereen die met RNA heeft gewerkt, weet dat het ontzettend kwetsbaar is, maar toch krijgen bedrijven het voor elkaar om zo’n fragiel molecuul in te zetten als vaccin. We gingen op onderzoek uit hoe ze dat doen.
Nederland en vooral België spelen wereldwijd een grote rol in de productie van SARS-CoV-2-vaccins. Eerder beschreven we hoe Pfizer in Puurs een aanzienlijk deel van zijn vaccins produceert, maar ook de GSK-fabriek in Waver gaat voor het Duitse bedrijf CureVac zo’n honderd miljoen doses maken, zo werd eerder dit jaar bekend. En op de Brightlands Chemelot Campus in Geleen opent binnenkort een fabriek van het Italiaanse Lonza, dat voor het Zwitserse Moderna jaarlijks 15 kg mRNA gaat maken, genoeg voor driehonderd miljoen doses. De wat betreft gewicht geringe productieschaal maakt dat er geen grote fabrieken nodig zijn: de productie van mRNA-vaccins lukt in een relatief kleine setting in reactoren van 5-50 l.
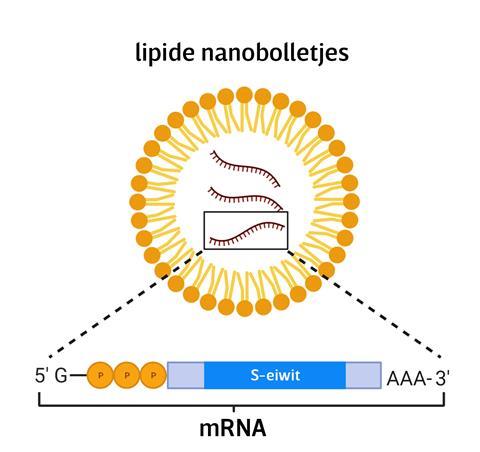
De fabriek in Geleen is een van de vele schakels die leiden van grondstof tot kant en klaar vaccin. Op details na is de productietechniek voor alle mRNA-vaccins hetzelfde, omdat de registratie-autoriteiten voor geneesmiddelen dit proces nu eenmaal kennen en accepteren. Alle mRNA-vaccins hebben dan ook dezelfde hoofdingrediënten: mRNA in een lipide nanodeeltje (zie afbeelding).
Dit ogenschijnlijk onooglijke bolletje een zeer innovatief product dat talloze obstakels weet te overwinnen. Naast de kwetsbaarheid van RNA zelf, die met slimme biochemische modificaties is verminderd, beschouwt ons lichaam vreemd RNA immers als een gevaar: het is een signaal voor de aanwezigheid van RNA-virussen als SARS-CoV-2 (zie kader). Een mRNA-vaccin zal deze natuurlijke afweer tegen het vreemd mRNA moeten omzeilen. Vandaar de jas van lipiden die het mRNA stabiliseert, afschermt voor het immuunsysteem en de cel in loodst.
‘De biologie is veel efficiënter dan de chemie in het vermenigvuldigen van lange nucleïnezuren’
Sander van Asbeck
Messenger RNA
De productie van mRNA is complex. RiboPro in Oss maakt mRNA-vaccins en biochemicus en ceo Sander van Asbeck vertelt dat vrijwel alle productiestappen biochemisch van aard zijn. ‘De biologie is namelijk veel efficiënter dan de chemie in het vermenigvuldigen van relatief lange nucleïnezuren zoals mRNA.’
Het startpunt van de productie is lineair DNA, vermenigvuldigd in bacteriën of via PCR. In vitro vertaalt T7 RNA-polymerase dit DNA tot RNA. ‘T7 doet dit werk zelfstandig, zonder hulpenzymen en is vrij tolerant met betrekking tot de reactiecondities’, legt Van Asbeck uit. Het polymerase rijgt de vier nucleotiden aan elkaar tot een enkelstrengs RNA-molecuul van honderden tot duizenden ribonucleotiden.
Zuivering van het RNA is vervolgens cruciaal. T7 stopt soms niet aan het einde van een DNA-template, maar keert om en maakt zo dubbelstrengs RNA. Dat leidt in het lichaam tot een soms zeer hevige immunologische reactie. Het mag dus absoluut niet in het vaccin zitten. Van Asbeck: ‘Een van de mogelijkheden is zuivering met behulp van cellulosevezels in een ethanol/zoutbuffer waarin het dubbelstrengs RNA aan de vezels bindt en het enkelstrengs RNA in oplossing blijft.’
Enkelstrengs RNA is nog geen mRNA. Daarvoor zijn nog twee enzymatische modificaties nodig. Aan de kant waar de cellulaire eiwitfabriek – het ribosoom – start met lezen, komt een guanosinetrifosfaat, de zogenoemde 5’ cap. Aan het andere uiteinde komt een poly-A tail, een reeks adenosines die het RNA stabiliseert. Ondanks de poly-A tail is mRNA chemisch niet stabiel: het degradeert door hydrolyse. ‘Het helpt daarom om het mRNA in te pakken in een lipide nanodeeltje, dan zit er minder water in de buurt van het mRNA en kan er dus minder hydrolyse plaatsvinden’, zegt Van Asbeck.
Daarmee komen we bij de tweede stap van het productieproces van de mRNA-vaccins. Die vindt meestal plaats bij een ander bedrijf, dat gespecialiseerd is in het inpakken van het mRNA in een lipide nanodeeltje.
‘Heel simpel’
‘Zo’n lipide nanodeeltje bestaat uit vier soorten lipiden’, legt Enrico Mastrobattista uit. Hij is hoogleraar pharmaceutical biotechnology & delivery in Utrecht en onderzoekt vectoren voor het afleveren van nucleïnezuren in de cel. ‘Het belangrijkste is een ioniseerbaar lipide dat positief geladen is bij pH 5, dat is tijdens bereiding en bewaren, en zijn lading verliest bij pH 7, dus in het lichaam.’ Het positief geladen lipide vormt via een elektrostatische interactie een complex met het negatief geladen mRNA. Dit lipide-mRNA-complex is de kern van het nanodeeltje. Daaromheen zitten helperlipiden als cholesterol en neutrale fosfolipiden. Een lipide met polyethyleenglycol (PEG) gebonden aan zijn polaire kop vormt de buitenkant van het nanodeeltje. Het PEG vergroot de oplosbaarheid en voorkomt klontering van deeltjes (zie afbeelding).
De opbouw van het nanodeeltje klinkt complex, de productie ervan is volgens de hoogleraar ‘heel simpel’. De deeltjes vormen namelijk vanzelf door twee vloeistofstromen – mRNA in water en lipiden in ethanol – bij elkaar te brengen. Dit gebeurt bijvoorbeeld in een T-junction, waarin twee vloeistofkanalen samenkomen in één kanaal. Mastrobattista: ‘De specifieke vorm van de T-junction stimuleert de elektrostatische interactie tussen de deeltjes. De deeltjesgrootte kun je beïnvloeden door de stroomsnelheid en druk te variëren.’
Na de vorming van de nanodeeltjes volgt de zuivering met tangentiale of crossflow membraanfiltratie waarbij gebufferd water het oplosmiddel vervangt, zonder dat daarbij de concentratie van de nanodeeltjes verandert; dit voorkomt aggregatie. Het eindproduct is geschikt voor steriele verwerking in flacons en spuiten, iets wat doorgaans in weer een andere fabriek gebeurt.
RNA als vijand
De menselijke cel tolereert RNA alleen in de celkern – waar het gemaakt wordt – en in het cytosol waar ribosomen de informatie uit het mRNA vertalen naar eiwitten. RNA dat van buiten in de cel doordringt, is een teken voor gevaar, bijvoorbeeld voor de aanwezigheid van virussen. De verdediging tegen RNA begint al buiten het lichaam op de huid waar het RNA-splitsende enzym ribonuclease (RNAse) alomtegenwoordig is. RNAse’s zijn chemisch zeer stabiel, je kunt geen deurkruk of ander door mensenhanden aangeraakt object vinden zonder RNAse.
Mocht een RNA-virus in het lichaam komen, dan reageert het immuunsysteem onmiddellijk; viraal ribonucleïnezuur is zeer immunogeen. Tenslotte is er nog een derde verdedigingslinie, die is gebaseerd op de manier waarop virussen de cel in komen. Tijdens dit proces, endocytose genoemd, ontstaan endosomen, door lipiden omgeven blaasjes die afsplitsen van de celmembraan naar het binnenste van de cel. In deze endosomen zitten TOLL-like receptors (TLR) die viraal RNA herkennen en de cel aanzetten tot een tijdelijke onderbreking van de eiwitsynthese of zelfs apoptose (zelfdoding).
Toch chemie
Een toekomstig alternatief voor de lipiden in het nanodeeltje zijn biologisch afbreekbare polymeren als poly(amidoamine). ‘Deze deeltjes vormen een chemische oplossing voor een biologisch probleem’, zegt organisch chemicus Michiel Lodder, ceo van 20Med Therapeutics, een spin-off van de Universiteit Twente. 20Med Therapeutics ontwikkelde een methode waarbij poly(amidoamine) mRNA aflevert in de cel dankzij een bioresponsive switch. Lodder: ‘Disulfide-bruggen houden het deeltje bij elkaar. Pas in de cel breken de bruggen, onder invloed van het antioxidant glutathion dat vooral in het cytosol voorkomt.’
De productie van de polymeer-mRNA-nanodeeltjes kent één groot verschil met de productie van de lipide-mRNA-nanodeeltjes: het inbouwen van het mRNA vindt achteraf plaats. ‘Het positief geladen deeltje heeft een open, gel-achtige structuur die negatief geladen moleculen als mRNA opneemt’, zegt Lodder. ‘We kunnen de deeltjes dus eerst produceren en later het mRNA toevoegen. Dat levert flexibiliteit waarmee we snel op een veranderende vraag kunnen reageren.’
20Med Therapeutics liet zien dat hun vaccin tegen SARS-CoV-2 bij proefdieren een goede immunologische respons oplevert. Samen met de Universiteit Twente en de Wageningen Universiteit onderzoekt het bedrijf of aangepaste versies van het vaccin ook goede bescherming bieden tegen nieuwe varianten van het virus.
Toekomst
Wat gebeurt er na COVID19, als de wereld gevaccineerd is en de ziekte is uitgedoofd tot griep-achtige proporties? Gelet op het enorme succes van mRNA-vaccins zal er voor de meeste productiefaciliteiten werk blijven. Alleen al Moderna ontwikkelt momenteel negen vaccins tegen verschillende infectieziektes.
Aan de productiekant werkt ook RiboPro aan vooruitgang. Van Asbeck: ‘Niet al het mRNA blijkt immunogeen. We proberen het mRNA te vertalen met ‘synoniemen’ in de genetische code die toch hetzelfde eiwit opleveren, maar niet de immunogene sequenties bevatten. Er is dan geen pseudo-uracil nodig en dat maakt het mRNA effectiever. Daarnaast streven we naar extreme zuiverheid van het mRNA, vrij van bivalente zouten die hydrolyse versnellen. Zuiver mRNA is langer houdbaar bij hogere temperaturen.’
Ook de ontwikkeling van lipide- en polymeer-nanodeeltjes krijgt aandacht, waarbij de focus ligt op de doelgerichte aflevering van nucleïnezuren in specifieke weefsels en organen. Al met al versnelde de COVID19-pandemie de introductie van een nieuwe therapeutische techniek, die beter schaalbaar, sneller aanpasbaar en – op termijn – goedkoper is. De mRNA-vaccinatietechniek zal een blijvende plek in de geneeskunde veroveren.
mRNA-vaccins in ontwikkeling (een onvolledig overzicht)
Moderna:
- Nipahvirus
- Zikavirus
- Humaan immunodeficiëntievirus
- Ebstein Barr-virus
- Cytomegalovirus
- Respiratoir syncytieel-virus
- Influenzavirussen
- Humaan metapneumovirus
- Para-influenzavirussen
Pfizer:
- Influenzavirussen
Curevac:
- Malariaparasiet
- Rotavirus
- Rabiësvirus
- Lassavirus
- Gelekoortsvirus
Websites
Wij zijn niet verantwoordelijk voor de inhoud van externe sites



















1 Opmerking van een lezer