Onverwacht werd Pfizer-topman Marc Kaptein een van de gezichten van de COVID-19-pandemie. We spraken Kaptein – spreker op de Avond van de Chemie op 14 oktober – onder meer over de technologie van het mRNA-platform en de prijs van vaccins.
Marc Kaptein zocht, na een korte carrière in de gynaecologie en verloskunde, ‘meer de innovatie-gedreven kant van de geneeskunde’, zoals hij het zelf formuleert. Die vond hij in de farmaceutische industrie. Op dit moment is hij de Nederlandse medisch directeur van Pfizer, het farmaceutische bedrijf dat met zijn mRNA-vaccintechnologie voor sommigen symbool staat voor de uitweg uit de coronacrisis, en voor anderen voor ‘big pharma’ dat per definitie niet te vertrouwen is.
Ondanks de druk en verantwoordelijkheid die Kaptein al maanden moet voelen, komt hij opvallend ontspannen over en maakt hij regelmatig tijd om de media te woord te staan, brieven te sturen of zelf te bloggen. ‘We vonden vanaf het begin dat we een positieve bijdrage zouden kunnen leveren aan de vaccinatiebereidheid, en dat we daar ons best voor wilden doen. Dat heeft geleid tot proactieve openheid vanuit Pfizer. Maar het wordt ook van ons geëist door de burger, die op zoek is naar informatie, die het uit onze handen trekt. Als we het niet zouden doen, zou dat leiden tot wantrouwen en dat wilden we zo veel mogelijk voorkomen.’

De rijpheid van jullie nieuwe vaccintechnologie op basis van mRNA lijkt precies op tijd te zijn gekomen. Hoe is dat gegaan?
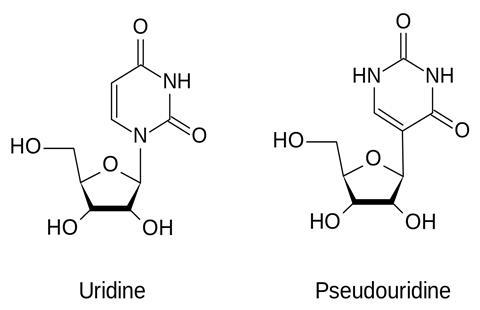
‘Het ontwikkeltraject is al in de jaren negentig gestart, dat weten veel mensen niet; we hebben alleen aan het eind een sprintje getrokken. Een van de grootste uitdagingen was de sterke afweerreactie tegen het geïnjecteerde RNA. RNA is weliswaar een lichaamseigen verbinding, maar komt normaliter niet voor buiten de cel; het immuunsysteem slaat dan aan en wil het opruimen. Dat hebben we opgelost door in het RNA uridine te vervangen door pseudo-uridine (zie ook kader, red.). Dat inzicht kwam een jaar of twee geleden. De tweede uitdaging betrof het nanoparticle, de lipidecapsule om het RNA heen. Het is essentieel dat dat efficiënt fuseert met de celmembraan, zodat het mRNA de cel in kan. Het is pas recent gelukt om de precieze samenstelling van lipiden te vinden waarbij dat proces optimaal verloopt.’
Gelijk met Pfizer/BioNTech ontwikkelde Moderna ook een mRNA-vaccin. Waarin verschilt hun vaccin van dat van jullie?
‘Eigenlijk verschillen ze niet wezenlijk. Moderna liep een aantal maanden op ons voor, waardoor ze al stabiliteitsstudies hadden kunnen doen en zodoende een beter inzicht hadden over de exacte bewaarcondities van hun vaccin. Wij konden die studies pas doen terwijl ons vaccin al op de markt was, vandaar dat we voor de praktisch gezien maximaal haalbare bewaarcondities moesten gaan, namelijk -70°C. Maar inmiddels blijkt de stabiliteit van de nanoparticles beter dan gedacht. We weten nu dat we het twee weken bij -20°C kunnen vervoeren. Dat is niet triviaal: bij -70°C heb je droogijs nodig en daarvan mag je om veiligheidsredenen maar een beperkte hoeveelheid door de lucht vervoeren. Daarnaast hebben we de bewaartermijn bij koelkasttemperatuur opgerekt van vijf dagen naar een maand.’
Dit gaat nog over hetzelfde vaccin als waar jullie mee begonnen?
‘Ja, de samenstelling is precies hetzelfde. Maar we hadden in het begin die stabiliteitsdata niet. We kunnen het ons natuurlijk niet veroorloven om midden in de pandemie te gaan sleutelen aan een goed werkend vaccin, al betreft het alleen de capsule. Ik sluit niet uit dat we de samenstelling daarvan in de toekomst nog verder gaan verfijnen, maar dat vereist ook weer een nieuwe fase drie-studie. Dat gaan we nu niet doen. En is ook niet nodig, overigens.’
‘Onze nieuwe ceo is wel van de bold moves’
We kennen inmiddels de cijfers over de hoge effectiviteit van de mRNA-vaccins. Wat zijn verder de voordelen?
‘Dat is in de eerste plaats de mogelijkheid om de technologie snel aan te passen. Bij een snel muterend virus als het coronavirus is dat een geweldig voordeel. Als er een variant opduikt waartegen het vaccin niet effectief is, kunnen we het vaccin binnen honderd dagen updaten. In de tweede plaats is dat de schaalbaarheid. Als je de technologie eenmaal in de vingers hebt, kun je er heel snel heel veel van maken. We hadden eerst de hoop in 2021 zo’n 1,2 miljard doses te kunnen produceren, maar door het vrijwillig licenseren van de technologie en samenwerking met bedrijven als Novartis en Sanofi is dat inmiddels zo’n 3 miljard. En volgend jaar 4 miljard.’
Dat is met de kennis van nu, maar verschillende andere grote farmaceutische bedrijven, waaronder GSK, de grootste vaccinproducent ter wereld, zijn met de technologie gestopt omdat ze het niet werkend kregen.
‘Het is in feite een grote gok geweest dat wij er samen met BioNTech wel mee door zijn gegaan. Wat hielp is dat we sinds anderhalf jaar een nieuwe ceo hebben die wel van de bold moves is. Hij zag snel dat dit een belangrijke kans zou kunnen zijn voor Pfizer en was bereid het risico te nemen. En om je een idee te geven: dat was een risico van $ 2 miljard. Zoiets kan ook misgaan.’
Maar nu gaan jullie hier goed aan verdienen.
‘Ja, dat klopt. Daar zijn we ook open over. Enerzijds moeten we natuurlijk de aandeelhouders tevreden houden: we zijn een commercieel bedrijf dat winst moet maken. Anderzijds hebben we vanaf het begin gezegd dat we onze maatschappelijke verantwoordelijkheid willen nemen. Daarom bieden we alleen al in 2021 een miljard doses voor midden-inkomenslanden aan tegen gereduceerd tarief en voor lage-inkomenslanden tegen kostprijs.’
‘Voor de productie van ons vaccin heb je machines nodig die vorig jaar nog niet bestonden’
mRNA-technologie is nieuw en duur. Verwachten jullie dat de prijs snel zal dalen door het succes en de schaalvergroting?
‘Ik durf het wel te challengen of het duur is. Ik denk dat je moet spreken van waardevol. Veel andere vaccins, bijvoorbeeld tegen pneumokokkenziektes of meningitis, zijn duurder dan ons mRNA-vaccin tegen SARS-CoV-2. En de winst die we maken, gaat grotendeels weer terug naar R&D van nieuwe medicijnen. We zijn momenteel bezig met een virusremmer, een cysteine-like protease inhibitor, specifiek tegen coronavirussen. Zoiets bestaat nog niet. Daar hebben we dit jaar € 600 miljoen in geïnvesteerd. Hopelijk lukt het in het vierde kwartaal van dit jaar om de eerste data te hebben en misschien kunnen we dan een versneld toelatingstraject in. Zo’n virusremmer kan de wereld helpen om een volgende golf te dempen, of om de mensen te beschermen bij wie een vaccin niet goed werkt.’
De patenten van de mRNA-technologie liggen bij de vaccinontwikkelaars. Je hebt eerder gezegd dat je een tegenstander bent van het vrijgeven van de patenten, zoals sommigen bepleiten. Kun je dat standpunt toelichten?
‘Het opheffen van patenten lost een aantal andere problemen niet op. De grondstoffen zijn schaars, met name de lipiden voor het nanoparticle; er zijn maar een paar partijen die dat kunnen produceren. Met een soort veredelde magnetron moeten we die nanoparticles ook nog op exact de juiste grootte maken. En tot voor kort konden we niet in zulke grote hoeveelheden mRNA produceren. Al die machines bestonden vorig jaar nog niet. Daarnaast heb je natuurlijk hoogopgeleid personeel nodig en complexe productiefaciliteiten. Aan al die factoren is momenteel een tekort. Als je de patenten vrijgeeft, ga je zien dat de vraag naar die schaarse middelen toeneemt en dat ze aanvankelijk minder efficiënt gebruikt worden door nieuwe producenten. Het is een reëel risico dat er daardoor op korte termijn mínder vaccins beschikbaar komen.
Op de langere termijn is het een ander verhaal, maar dan is er waarschijnlijk geen sprake meer van een pandemie. Dus moet je je afvragen of het opschorten van patentbescherming onderaan de streep wel zo gunstig uitpakt. Het betekent namelijk ook dat de farmaceutische industrie minder geneigd zal zijn om te investeren in nieuwe technologie als ze het risico lopen dat een patent van ze wordt afgepakt, om het maar even zo te formuleren.’
‘Als er een variant opduikt waartegen het vaccin niet effectief is, kunnen we het vaccin binnen honderd dagen updaten’

Gaan we de mRNA-technologie ook voor andere vaccins zien?
‘Voordat de COVID-19-pandemie uitbrak, was het plan om eerst een griepvaccin te lanceren op basis van het mRNA-platform. Daar zijn we vanaf 2018 samen met BioNTech mee bezig en daar wordt nog steeds hard aan getrokken. Dit najaar gaan we een fase drie-studie in. De mRNA-technologie is met name geschikt voor snel muterende virussen als griep en SARS-CoV-2. Daar zit voor nu vooral de toegevoegde waarde. Op de langere termijn zal het vast breder worden ingezet, al vraag ik me af of we sommige bestaande, zeer effectieve en veilige vaccins ooit zullen vervangen. Ik denk dat er altijd een mix zal blijven.’
Wat komt er na het mRNA-platform?
‘De ontwikkeling gaat zeker door. Naast de huidige technologie op basis van modified mRNA hadden we met unmodified mRNA en saRNA nog twee kandidaten. Die tweede leverde zoals gezegd een ongewenste immuunrespons op, die derde is nog steeds kansrijk, maar een stuk complexer. saRNA heeft de eindstreep nog niet gehaald, maar blijft interessant en we blijven er zeker in investeren. Het grote voordeel van saRNA is immers dat het zichzelf vermenigvuldigt in je cellen. We denken dat dat een factor vijftig kan schelen qua dosis. Moet je je voorstellen wat het betekent in een pandemische situatie als je vijftig keer zo veel vaccins kunt maken. Dan hadden we nu al meer dan genoeg doses gehad voor de hele wereldbevolking.’
Het mRNA-vaccin ontleed
Eén dosis van het Pfizer/BioNTech-vaccin bestaat uit enorme hoeveelheden nanoparticles, wat in feite een capsule is van cholesterol en drie complexere lipiden. In die capsule bevindt zich een buffer en een beperkt aantal mRNA-fragmenten, het werkzame bestanddeel. Eén mRNA-fragment is 4.284 nucleotiden lang en bestaat uit vijf elementen:
- 5′-cap: een signaal aan de ‘kop’ van het RNA-fragment dat het stabiliseert en de translatiemachinerie aantrekt;
- 5′-UTR: een deel van het RNA aan het begin dat niet wordt afgelezen, maar belangrijk is voor de start van de vertaling van het RNA naar eiwit (translatie);
- De nucleotidesequentie die codeert voor het SARS-CoV-2 spike-eiwit;
- 3′-UTR: een deel van het RNA aan het eind dat niet wordt afgelezen, maar belangrijk is voor stabilisatie van het RNA en efficiënte translatie;
- Poly-A-staart: twee gesegmenteerde fragmenten van meerdere adeninenucleotiden achter elkaar die de stabiliteit van het RNA vergroten en ongewenste recombinatie voorkomen.
Cruciaal voor het reduceren van de immuunrespons op het lichaamsvreemde RNA (dus niet het spike-eiwit dat voor de immuniteit moet zorgen, maar de primaire reactie op het RNA-vaccin zelf) bleek het vervangen van de gebruikelijke uridinenucleotide in het RNA door pseudo-uridine:





















2 Opmerkingen van lezers