Gemakkelijk chirale moleculen maken is de droom van elke syntheticus. Francesco Mutti en zijn team gebruikten gemodificeerde enzymen om amines met twee stereocentra te maken in een één-pot-synthese, met hoge precisie en efficiëntie.
Het is geen geheim dat het bewerkstelligen van zuivere chiraliteit heel belangrijk én heel lastig is. Maar gelukkig zijn er enzymen; natuurlijke katalysatoren met, meestal, een zeer specifieke functie. In cellen werken ze heel goed samen, maar in het lab is het een ander verhaal.
‘Telkens als je een chemische transformatie met behulp van enzymen wilt doen waarbij je meerdere stappen tegelijkertijd moet uitvoeren, is de compatibiliteit een probleem’, zegt Francesco Mutti, universitair hoofddocent biokatalyse aan de Universiteit van Amsterdam. Maar onlangs hebben Mutti en zijn groep een belangrijke bijdrage geleverd aan een oplossing voor dit probleem.
‘Deze paper is echt de kers op de taart’
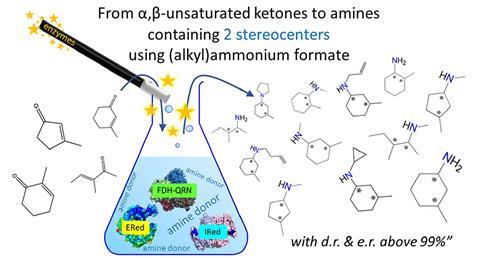
Via genome mining vonden Mutti en zijn collega’s senior scientist Tanja Knaus en de onlangs gepromoveerde Maria Corrado van nature voorkomende enzymen waarvan nog niet bekend was dat ze imines reduceerden. Met die enzymen konden ze α,β-onverzadigde ketonen omzetten in amines met twee chirale centra.

Daarbij bereikten ze zowel een hoge chemische zuiverheid als specificiteit (beide >99%). ‘Tot nu toe was niemand er echt in geslaagd om hier een breed toepasbare manier voor te verzinnen’, legt Mutti uit. Met twee chirale centra heb je vier manieren om een verbinding te synthetiseren, dus je moet de reactie kunnen sturen naar een specifiek stereoisomeer. En dat is precies wat zijn team heeft gedaan, op een manier die ook voor andere onderzoekers zeer toegankelijk is.
Geen bijproducten
Mutti: ‘De uiteindelijke chiraliteit wordt bepaald door de geometrie of elektrostatische kenmerken van de actieve sites van enzymen, in combinatie met de oriëntatie van het substraat. Door deze facetten krijg je slechts één product met vrijwel geen bijproducten.’ Dat komt omdat het substraat zich voor een reactie op een specifieke afstand van het enzym en de cofactor moet bevinden. Omdat de active site van een enzym zelf chiraal is, heb je voor de verschillende producten verschillende enzymen nodig – een soort gereedschapskist dus. ‘Je zou het kunnen vergelijken met legoblokjes, waarbij je blokjes zo combineert dat ze op elkaar passen en andere combinaties onmogelijk zijn.’
’Je kunt het enzym gewoon gebruiken zoals elke andere katalysator, maar met mildere reactieomstandighede’
Het team gebruikte een combinatie van ene-reductases (EReds, die een C=C dubbele binding reduceren tot C–C) en imine-reductases/reductieve aminases (IReds/RedAms, die N=C reduceren tot N–C). Als hulpenzym voor de recycling van de cofactor – die de reacties laat lopen – gebruikten ze NADP-afhankelijk formiaatdehydrogenase (FDH) en een buffer van (alkyl)ammoniumformiaat (HCOONH4/HCOONH3R). De ammonium- of alkylammoniumformiaatbuffer fungeerde zowel als aminedonor als bron van reductie-equivalenten. Met deze combinatie bereikten ze een diastereomere en enantiomere verhouding van meer dan 99%.
Milde omstandigheden
Het was echter niet gemakkelijk. ‘De complexiteit van dit soort werk ligt in het creëren van de juiste biokatalysator’, zegt Mutti. ‘Als je deze methode wilt gebruiken heb je een enzym nodig dat zeer actief en stereospecifiek is, op het juiste molecuul werkt, stabiel is, enzovoort.’ Om deze enzymen te maken is interdisciplinariteit de sleutel. ‘Tanja Knaus, een briljante onderzoeker in mijn groep, had een heel goede synergie met mijn promovenda, Maria Corrado [inmiddels werkzaam bij Aspen API, red.]. Tanja houdt zich bezig met biokatalyse en enzymologie, terwijl Maria organisch scheikundige is, dus ze vulden elkaar perfect aan voor dit werk. Samen zijn ze co-auteur van zes papers, en deze laatste is echt de kers op de taart.’
’Er lijkt een discrepantie te bestaan tussen de manier waarop verschillende Europese landen biokatalyse gebruiken’
De beginfase van dit onderzoek is dus vrij complex, maar als je eenmaal de juiste enzymen in je gereedschapskist hebt zitten, is het uitvoeren van de eigenlijke reacties heel eenvoudig, aldus Mutti. ‘Je kunt het enzym gewoon gebruiken zoals elke andere katalysator, maar met mildere reactieomstandigheden: werken in water, lucht, zonder druk en misschien met een klein beetje warmte. In dat opzicht is het eenvoudiger dan puur organische chemie.’
Conservatief
Nu de methodeontwikkeling ten einde is, hoopt Mutti dat andere onderzoekers en bedrijven de methoden oppikken. ‘Bij een groot bedrijf waar automatisering mogelijk is, zou je in een paar maanden interessante enzymen kunnen maken’, zegt hij. ‘En dat zal alleen maar sneller worden, zeker met de komst van kunstmatige intelligentie en rekenmethoden. Er is dan geen behoefte meer aan veel trial-en-error zoals bij ons het geval was.’ Het kunnen gebruiken van deze zeer milde omstandigheden is veel duurzamer voor het creëren van complexe moleculen in de farmaceutische industrie. ‘Bovendien zal de toegenomen snelheid en het gemak waarmee geneesmiddelen kunnen worden gemaakt, veel mensen helpen’, aldus Mutti.
Hij benadrukt dat het potentieel van biokatalyse grotendeels onderbenut blijft. ‘Er lijkt een discrepantie te bestaan tussen de manier waarop verschillende Europese landen dit gebied gebruiken. In Nederland is de chemische gemeenschap nog wat conservatiever wat katalyse betreft in vergelijking met bijvoorbeeld Oostenrijk, Duitsland of het Verenigd Koninkrijk.’ Sommige onderzoekers hebben nog vooroordelen tegen biokatalyse die twintig jaar geleden relevant waren, maar nu niet meer. ‘Dat is erg jammer, want als meer mensen het potentieel van biokatalyse zouden erkennen, zou de industrie zich meer bewust worden van het vakgebied, en ik denk dat dit erg gunstig zou zijn.’
Knaus, T., Corrado, M.L. en Mutti, F.G. (2022) ACS Catal. 12(23), DOI: 10.1021/acscatal.2c03052















Nog geen opmerkingen