Eindhovense en Nijmeegse wetenschappers zijn er in geslaagd om interleukine-4 zo te verpakken dat het wordt afgeleverd aan immuuncellen in de milt en het beenmerg, zo schrijven ze in Nature Biomedical Engineering. Dat biedt uitzicht op een therapie tegen sepsis en andere levensbedreigende aandoeningen die gepaard gaan met een op hol geslagen immuunsysteem.
Interleukines reguleren de immuunrespons via het oproepen of remmen van ontstekingsreacties. Logischerwijs zouden anti-inflammatoire interleukines daarom een dempend effect moeten hebben op trained immunity, het ‘geheugen’ van onze aangeboren afweer. Dankzij deze relatief recent ontdekte eigenschap, voor het eerst beschreven door de Nijmeegse hoogleraar Mihai Netea, staat het aangeboren immuunsysteem na een eerste trigger nog langere tijd paraat, waardoor er bij een tweede trigger een veel snellere en intensievere respons optreedt.
Paradoxaal
Op het eerste gezicht zijn anti-inflammatoire werking en trained immunity dus tegenstelde effecten. Daarom was de verrassing groot toen Rutger Röring, promovendus in de groep van Netea, ontdekte dat interleukine-4 (IL-4) in primaire humane monocyten (witte bloedcellen) ontstekingsremmend werkte én trained immunity activeerde.
Dit paradoxale karakter van IL-4 was niet alleen nice to know, er dook ook meteen een idee op voor een mogelijke toepassing. ‘Bij mensen met ernstige infecties treedt vaak ook immunoparalysis op’, legt hoogleraar precision medicine Willem Mulder (Radboudumc/TU Eindhoven) uit. ‘Door de aanhoudende inflammatie wordt het immuunsysteem als het ware lamgeslagen, waardoor er geen afweerrespons meer op gang komt. Dat is een groot klinisch probleem, want je kunt hier eigenlijk niks tegen beginnen en het gevolg is dat patiënten vaak overlijden aan een andere opportunistische infectie, zoals een longontsteking.’
Dirigeren
IL-4 zou dus, in theorie, tegelijkertijd de hyperinflammatie kunnen afzwakken en het immuunsysteem juist een por kunnen geven om weer in actie te komen. Maar daarvoor moet het wel terechtkomen in de juiste immuuncellen en dat betekent dat IL-4 naar de milt en het beenmerg moet, want daar zitten veel monocyten. Mulder: ‘Dat was ons probleem. In vitro lukt dat wel, maar in een levend organisme dirigeer je IL-4 niet zomaar naar de myeloïde cellen [de voorlopers van de monocyten, red.]. Verpakken in een standaard lipide nanobolletje is niet zinvol, omdat IL-4 dan wordt opgenomen voor de cel. Met onze fusie-eiwit technologie waarbij we IL-4 koppelen aan lichaamseigen apolipoproteïne A1 forceren we een interactie met het celoppervlak. ApoA1 dockt aan de buitenkant van de myeloïde cellen en dan kan IL-4 binden aan de relevante receptor.’
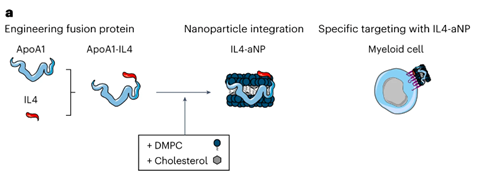
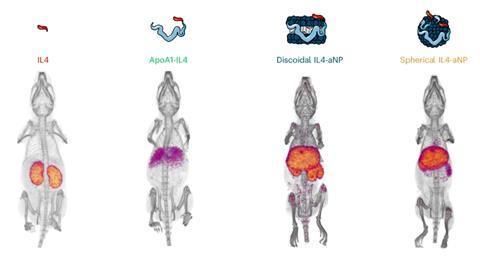
Studies in muizen lieten duidelijk het effect van ApoA1 en de nanoverpakking zien op de biodistributie. Het ‘kale’ IL4 en ApoA1-IL4 kwamen vooral terecht in respectievelijk de nieren en de lever, terwijl de verpakte versies in schijf- of bolvormige nanodeeltjes juist ophoopten in de milt en het beenmerg. Vervolgstudies in non-humane primaten lieten ook de gewenste opname en een goed veiligheidsprofiel zien. Mulder: ‘IL-4 is soort-specifiek en humaan IL-4 werkt niet in muizen. Om een goed beeld te krijgen van de veiligheid in mensen, kun je daarom niet alleen in muizen testen.’ En dan is nog de vraag of het verpakte IL-4 ook daadwerkelijk een gunstig effect geeft. In een aangepast muismodel lijkt dat ook het geval te zijn. De activiteit van de immuunrespons nam toe, terwijl hyperinflammatie juist verminderde.
Infarct
Klinische studies in mensen zijn de volgende stap. Volgens Mulder zijn er voldoende aandoeningen waarvoor een IL4-therapie mogelijk relevant is. ‘De combinatie van hyperinflammatie en immunoparalysis zie je vaak bij sepsis. Daar lijkt niet zoveel interesse in te zijn, maar ieder jaar overlijden in Nederland ongeveer 3500 mensen hieraan. Maar het speelt ook bij een myocard- of een herseninfarct. Die patiënten overlijden vaak aan hyperinflammatie. Het infarct zorgt voor een overreactie en het hele systeem slaat op hol.’
Hij kijkt tevreden terug op het hele project. ‘Ik vind dit echt een schoolvoorbeeld van synergie en team science. Vier jaar geleden is onze eerste promovendus David Schrijver gaan werken aan deze fusie-eiwit technologie. Door de samenwerking met immunologen van het Radboudumc zitten alle aspecten van basale biologie en immunologie tot technische toepassing en translatie in deze studie. Mihai en ik hebben er ook bewust voor gekozen om niet alle afzonderlijke resultaten te publiceren in kleinere vorm, maar juist het hele traject te doorlopen zodat we met een echt goede paper konden komen.’




















Nog geen opmerkingen