Bacteriën zwemmen met flagellen en dankzij een slim schakelsysteem kunnen ze zo op een doel afgaan. Recent onderzoek laat in meer detail zien hoe de aandrijving van de flagel van richting verandert.
Veel bacteriesoorten hebben één of meer flagellen. Dankzij deze om hun as roterende lange zweepstaarten kunnen ze bewegen en zoeken naar voedingsstoffen in de omgeving of een slachtoffer om te infecteren. De flagel kan snel van draairichting veranderen en dat bepaalt de koers van de bacterie. Hoe dat omschakelen precies in zijn werk gaat is al jaren onderwerp van onderzoek.
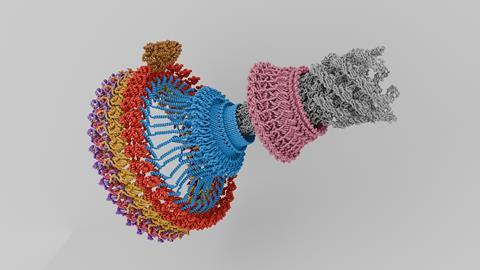
Flagellen zijn namelijk een fraai staaltje bio-nanotechnologie, want elk flagel zit vast aan een rotor: een ringvormig, draaiend eiwitcomplex met tientallen sub-units. Daarmee kan de bacteriecel stroming van protonen via motoreiwitten omzetten in rotatie linksom of rechtsom. De vraag is hoe precies de rotor van richting verandert.
Recent zijn twee papers verschenen in Nature microbiology die een scherper beeld geven. Zowel een team onder leiding van de Britse Susan Lea als die van de Amerikaanse Tina Iverson zoomen met de elektronenmicroscoop in op het schakelmechanisme. Ze laten zien hoe een kleine vormverandering in een eiwit de draairichting bepaalt.
Tandwielen
‘Ik denk dat de hoofdconclusie van beide artikelen erg op elkaar lijkt’, zegt Ariane Briegel, hoogleraar elektronen-cryotomografie en bacteriële chemotaxis aan de Universiteit Leiden. ‘De paper van Lea bekijkt het hele eiwitcomplex, de paper van Iverson analyseert een kleiner onderdeel. Maar dat levert ongeveer hetzelfde model van hoe de omschakeling zou kunnen werken.’
Vrij vertaald beschrijven Lea en Iverson een systeem met twee tandwielen. De ring van de flagel-rotor kun je zien als een groot tandwiel dat wordt aangedreven door een kleiner tandwiel: het motoreiwit (MotA/B). De vorm van het grote tandwiel bepaalt waar de motoreiwitten contact maken. Zit het motoreiwit aan de buitenkant dan draait de rotor tegen de klok in, raakt het de binnenkant, dan draait de rotor met de klok mee. In een animatie op YouTube (zie onder) laat de groep van Lea zien hoe dat schakelen in zijn werk gaat: in kleur het motoreiwit, in grijs de flagelrotor.
Of deze beschrijving op basis van microscopie honderd procent klopt is niet helemaal zeker, zegt Briegel. ‘Maar ik denk dat de resolutie nu heel hoog is en ik ben er eigenlijk wel van overtuigd dat dit model de werkelijkheid goed benaderd. Dat maakt het onderzoek spannend en interessant.’
Volgens Briegel draagt het onderzoek bij aan begrip van hoe bacteriën zich verplaatsen en richting zoeken. Bacteriën hebben namelijk sensoren in de celmembraan die chemische signalen oppikken, die de bacterie kan vertalen in een draairichting van het flagel: tegen de klok in beweegt de cel gestaag vooruit, met de klok mee gaat de cel tuimelen en dus heroriënteren. Zo ontstaat chemotaxis en kunnen bacteriën gericht op een doel af.
Briegel: ‘Het veranderen van draairichting van de flagel bepaalt hun pad. Heel veel bacteriesoorten kunnen bewegen op basis van dit systeem. Het is bovendien een belangrijk mechanisme, omdat sommige bacteriën flagellen gebruiken tijdens een infectie, waaronder salmonella en de cholera-bacterie.’
Chemosensoren
Briegels onderzoek richt zicht vooral op de structuur en werking van chemosensoren in de celmembraan van bacteriën. Er is volgens Briegel al behoorlijk veel bekend over hoe bacteriën chemo-sensorische informatie uit hun omgeving vertalen in de aansturing van flagellen. Vooral de relatief eenvoudige modelbacterie E. coli is wat dat betreft al gedetailleerd in kaart gebracht.
De uitdaging zit vooral in het karakteriseren van de chemosensoren van andere pathogenen, zoals Spirocheten die de ziekte van Lyme veroorzaken of Syfilis. ‘Wij bestuderen een bacterie uit deze groep die tandvleesontsteking veroorzaakt. Spirocheten hebben een andere bouw dan andere bacteriën, want hun cellen zijn erg langgerekt en dun, waardoor hun chemo-sensoren er anders uitzien dan in E. coli.’
Kennis van chemotaxis kan een aanknopingspunt bieden voor bestrijding van infecties. Toch zijn er voor zover bekend op dat gebied nog geen klinische trials aan de gang, zegt Briegel. ‘Je leest die toepassing wel vaak in subsidieaanvragen. Het zou natuurlijk mooi zijn als je het chemo-sensorische systeem van een bacterie kunt verblinden, bijvoorbeeld door stoffen die aan de receptoren op het celoppervlak binden.’
Bekijk ook de video van onze collega’s bij Chemistry World over dit onderzoek:















Nog geen opmerkingen