Het lab van nanowetenschapper Cees Dekker is erin geslaagd om de nanopore DNA sequencing-technologie zodanig aan te passen dat je er aminozuurvolgordes mee kunt bepalen.
DNA-sequencing kan op verschillende manieren, waarvan er meerdere inmiddels routine zijn geworden in een gemiddeld lab. Eiwit-sequencing daarentegen is veel lastiger en ligt voor de meeste niet-gespecialiseerde labs buiten de mogelijkheden. In het lab van nanotechnoloog Cees Dekker, universiteitshoogleraar aan de TU Delft, hebben onderzoekers nu een belangrijke stap gezet naar het sequencen van eiwitten door de bekende nanopore DNA sequencing-technologie zodanig aan te passen dat deze toepasbaar is op eiwitten.
‘Dit kan grote impact hebben op fundamenteel eiwitonderzoek en medische diagnostiek’
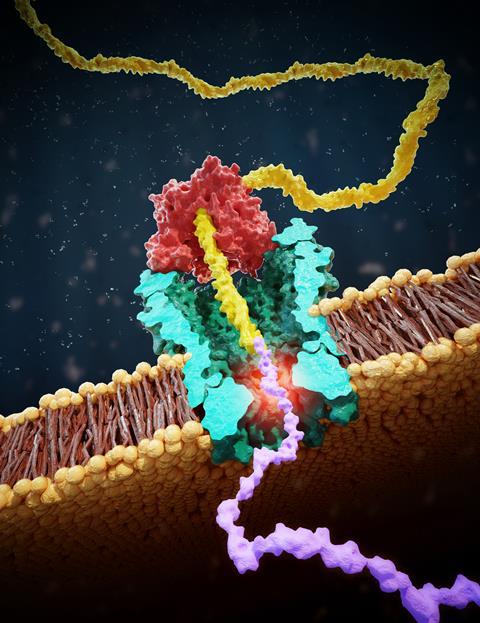
Nanopore DNA sequencing is gebaseerd op het concept dat je een DNA-streng door een minuscuul gaatje trekt. Dit gaatje is een opening in een membraan in een elektrolytoplossing. Als je een spanning aanbrengt over het membraan, dan zullen er ionen door de nanopore gaan stromen. Verstoringen in de stroom als gevolg van een DNA-streng die door de nanopore beweegt, zijn meetbaar en specifiek voor een nucleotide. ‘In de afgelopen dertig jaar is nanopore DNA sequencing ontwikkeld van een academisch idee tot een echt werkend apparaat, wat heeft geleid tot commerciële draagbare nanopore sequencers’, licht Dekker toe. ‘We breiden dit concept nu uit naar het lezen van afzonderlijke eiwitten. Dit kan grote impact hebben op fundamenteel eiwitonderzoek en medische diagnostiek.’
Proof-of-principle
De vertaalslag van de nanopore-techniek van DNA naar eiwit was niet triviaal. DNA en eiwitten lijken weliswaar op elkaar in die zin dat ze ieder bestaan uit een lange keten van afzonderlijke chemische bouwstenen, maar daar houdt de vergelijking wel een beetje op. Bij DNA zijn dit maar vier verschillende nucleotiden, bij eiwitten zijn dit wel twintig verschillende aminozuren. Bovendien is DNA uniform negatief geladen, maar kennen eiwitketens een bonte variëteit van positieve en negatieve ladingen en hydrofobe en hydrofiele aminozuren.
Sequencing van eiwitten met nanopore-technologie vereist daardoor een veel grotere gevoeligheid en een nauwkeurig beeld van de ionenstroom die past bij een specifiek aminozuur. Dat laatste deel van het onderzoek werd aangepakt door een groep onder leiding van Alek Aksimentiev aan de Universiteit van Illinois, die met simulaties van moleculaire dynamica uitzocht hoe de ionenstroomsignalen zich verhouden tot bepaalde aminozuren in de nanopore.
‘Maar de echte uitdagingen zijn conceptueler’, zegt Dekker. ‘We weten nog niet of het überhaupt kan om zo’n peptide netjes te transloceren door de nanopore. Daarnaast geeft het grote aantal aminozuren dat bijdraagt aan het signaal een astronomisch aantal combinaties.’ Het onderzoek van Dekker was namelijk een proof-of-principle met een enkel eiwit waarvan de aminozuurvolgorde bekend was. Henry Brinkerhoff, postdoc in Dekkers lab en eerste auteur van het artikel, verduidelijkt: ‘De novo sequencing, dus van een onbekend eiwit, kunnen we nu nog niet. Daarvoor moeten we eerst nog de signalen van dat enorme aantal peptiden karakteriseren om een kaart te maken die de specifieke ionenstroomsignalen verbindt met de aminozuurvolgorde.’
Gevoeliger
Dekker kijkt nog verder vooruit en speculeert over een toekomst waarin de techniek zo gevoelig is dat ook de specifieke posttranslationele modificaties van eiwitten te detecteren zijn. Eiwitten zijn namelijk zelden ‘af’ als ze van het ribosoom komen: er worden vaak nog extra chemische groepen aan de aminozuren gekoppeld die de functie van het eiwit verder verfijnen. Zo is bekend dat het aminozuur lysine nog een enkele, dubbele of zelfs driedubbele methylgroep kan krijgen, maar ook bijvoorbeeld glycosylering, fosforylering en acetylering zijn bekende posttranslationele modificaties.
Het extreem complexe geheel van deze modificaties bepaalt mede de uiteindelijke functie van het eiwit, maar de wetenschap heeft nog nauwelijks in beeld hoe dit precies werkt. Dekker: ‘We denken dat onze nieuwe aanpak ons in staat zal stellen dergelijke veranderingen te meten op enkel eiwitniveau, en zo een licht te werpen op de eiwitten die wij met ons meedragen.’



















Nog geen opmerkingen