Gebruik je vloeibaar gemaakt polyfluoretheen-gas in een elektrolyt voor een lithiumbatterij, dan krijgt die brandblussende en hittebestendige eigenschappen, aldus een paper in Nature Energy.
Batterijen wil je veilig, duurzaam en efficiënt hebben. Door aan de verschillende onderdelen van een batterij te sleutelen, kun je stap voor stap richting dat ideaalbeeld komen. Zo hebben Yijie Yin, Y. Shirley Meng en collega’s van University of California San Diego zich met name gericht op het elektrolyt van deze energiedragers om te kijken hoe je die brandveilig, hittebestendig en recyclebaar kunt maken.
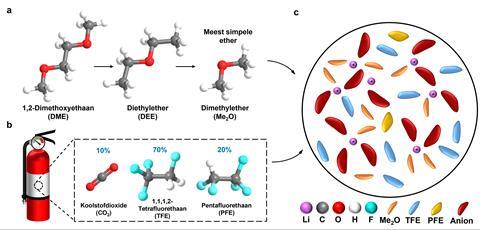
Een elektrolyt moet zout goed kunnen oplossen en een lage dampdruk, vriespunt, viscositeit en ontvlambaarheid hebben. De onderzoekers vonden deze eigenschappen in een combinatie van verschillende vloeibaar-gemaakte gassen (liquefied gas solvents). De keuze viel allereerst op dimethylether; die heeft van de ethers het laagste vriespunt en viscositeit en een goede interactie met lithiummetaal. Verder lieten ze zich inspireren door brandblussers met FS49C2, een combinatie van 1,1,1,2-tetrafluorethaan, pentafluorethaan en CO2. Die eerste twee pikten ze eruit, vanwege het lage smeltpunt, de matige dampdruk en de ‘brandblussende’ werking. Met die laatste eigenschap kun je vlamvorming sterk onderdrukken in batterijen onder wrange omstandigheden.
Kaarstest
Mix je deze vloeibare gassen met LiFSI en LiTFSI dan krijg je een over ‘t algemeen veiliger elektrolyt dat over een breed temperatuurbereik werkzaam is. Voor de liefhebbers: de elektrolyt behoudt >3 mS/cm ionische geleiding tussen de -78 en 80°C. Maar hoe goed werkt de elektrolyt als brandblusser? Om dat te testen deden de onderzoekers een vlamtest. Ze staken een kaars aan en plaatsten een buisje naast de vlam met een lage stroomsnelheid. In vergelijking met CO2 – die de kaars in zo’n 25 s uit kreeg – deed het elektrolyt het veel beter, ondanks de ontvlambare dimethylether die in het mengsel aanwezig was. In een kleine 6,5 s was de kaars uit.
Ook de elektrochemische eigenschappen zijn zeker niet verkeerd: Yin en collega’s lieten een Coulomb-efficiëntie van meer dan 99% zien bij lithium cycling gedurende 200 cycli en bij 3 mA/cm2 en 3 mAh/cm2. Daarnaast hadden Li/NMC622 batterijen met het elektrolyt over een lange tijd een stabiele cyclus tussen -60 en 55°C tot 4,2 V.
Recyclage
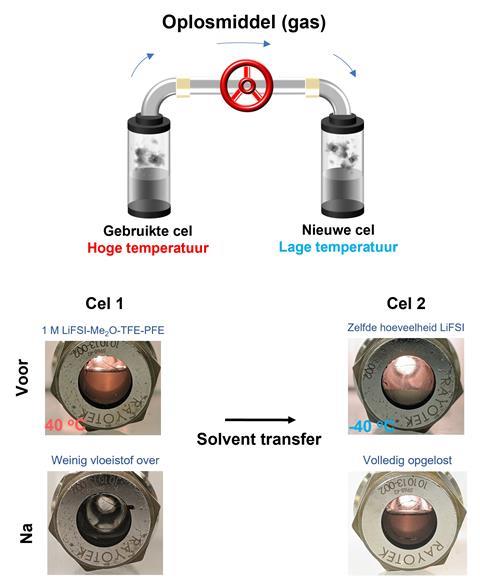
Allemaal leuk en aardig, maar zijn die fluorverbindingen niet schadelijk voor milieu en klimaat (zie ook dit nieuwtje over fluorkoolwaterstoffen)? Ook daar is aan gedacht door het team. Ze stellen een praktisch LGE-recycleproces voor, zodat de elektrolyt niet in het milieu terecht hoeft te komen. Sluit twee (batterij)cellen op elkaar aan met evenveel elektrolyt en zorg voor een temperatuur- en dampdrukverschil. Door een groot drukverschil (in het experiment uit de paper 143 psi vs. 13,9 psi) zal het meeste oplosmiddel in de cel met hoge temperatuur zich verplaatsen naar de lage temperatuur. Dat resulteert weer in eenzelfde concentratie elektrolyt. Met dit principe lieten ze zien dat het elektrolyt van de ene Li/NMC knoopcelbatterij in een nieuwe Li/NMC-cel terechtkwam en bijna identieke capaciteit en efficiëntie bezat.
Yin, Y. et al. (2022) Nature Energy 7, doi.org/10.1038/s41560-022-01051-4
















Nog geen opmerkingen