Bij de meest recent beschreven variant van CRISPR-Cas zijn verschillende subunits gefuseerd tot één groot eiwit. Dat biedt nieuwe mogelijkheden voor de farmacologie en biotechnologie.
‘Dit is echt weer iets helemaal nieuws’, vertelt hoofdonderzoeker Stan Brouns van de afdeling Bionanoscience van de TU Delft. ‘Niet alleen zitten verschillende subunits van het Cas-gedeelte aan elkaar gefuseerd, maar ook vonden we een stevige interactie met een eiwit dat betrokken is bij geprogrammeerde celdood. Dat kan betekenen dat deze variant van CRISPR-Cas in staat is om de bacterie tot zelfdoding aan te zetten zodra het niet lukt om het virus op te ruimen.’
‘Met deze variant kun je een bio-actief molecuul in het lichaam activeren door er iets af te knippen’
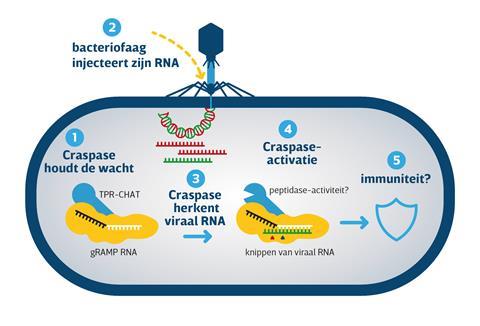
CRISPR-Cas is het biotechnologische precisie-schaartje dat een revolutie in de genetica heeft ontketend. De nieuwe variant die de groep van Brouns karakteriseerde – Type III-E genoemd – is volgens Brouns een volgende stap in bacteriële evolutie. ‘Meestal zijn de Cas-eiwitten, dus de nucleases die het virus herkennen en in stukken knippen, afzonderlijke eiwitten die aan elkaar binden en samen het CRISPR-Cas-systeem vormen. Bij dit nieuwe Type III-E zitten die afzonderlijke eiwitten aan elkaar vast. Bovendien knipt het heel specifiek enkelstrengs RNA, waar de meeste Cas-nucleases DNA knippen of, in het geval van Cas13, heel aspecifiek RNA.’ De onderzoekers noemen het fusie-eiwit giant Repeat Associated Mysterious Protein (gRAMP). ‘Giant’ omdat het maar liefst zo’n 1.800 aminozuren telt en daarmee veruit het grootste Cas-systeem uit één eiwit is, ‘mysterious’ omdat het nog niet helemaal duidelijk is wat alle afzonderlijke onderdelen doen.
‘We moesten snel zijn en konden daarom niet alle aspecten uitdiepen voor we het aanboden aan Science’, legt Brouns dat laatste uit. ‘Het is een enorm competitief veld en het bestaan van Type III-E was al ontdekt met bioinformatica.’ Na een conferentie vlak voor de zomer vermoedde hij dat een andere groep er ook mee aan de slag ging, waarna hij in een vroeg stadium contact zocht met Science over hun aanstaande resultaten. ‘Sam van Beljouw heeft vervolgens onder grote tijdsdruk de noodzakelijke proeven afgemaakt. Niet iedereen had dit gekund’, looft hij zijn promovendus. Het proces tussen het aanbieden van het manuscript en publicatie ging vervolgens ‘razendsnel, maar heel gedegen’, aldus Brouns.
’De bacterie offert zich als het ware op door zichzelf via Craspase te doden’
Een tweede interessante ontdekking betrof de associatie met het eiwit TPR-CHAT. ‘In tegenstelling tot bij hogere organismes is het in bacteriën meestal zo dat genen die bij elkaar in de buurt liggen op het genoom, samen een functie hebben’, legt Brouns uit. ‘Wij zagen dat TPR-CHAT vlakbij gRAMP op het genoom ligt. Vervolgens hebben we in vitro bindingsstudies gedaan en beide eiwitten blijken stevig aan elkaar te plakken, ook als CRISPR een doel-RNA heeft herkend.’
Het is nog niet helemaal duidelijk wat de functie van de interactie is, maar Brouns vermoedt dat het een systeem activeert dat we kennen als geprogrammeerde celdood. Hierbij knippen specifieke proteases belangrijke eiwitten in de cel doelbewust in stukken, wat de bacterie niet overleeft. TPR-CHAT lijkt op een specifiek soort protease genaamd caspase dat hierbij betrokken is. Brouns en Van Beljouw hebben het complex daarom alvast Craspase gedoopt, voor CRISPR-guided caspase. ‘Het nut van die geprogrammeerde celdood is dat het virus dat de bacterie binnendrong zich niet kan vermenigvuldigen, waardoor de bacteriën in de naaste omgeving gespaard blijven. De bacterie offert zich als het ware op door zichzelf via Craspase te doden.’

Brouns ziet veel potentieel voor de gRAMP-variant van CRISPR-Cas in de biotechnologie, ook in menselijke cellen. ‘Met bestaande systemen heb je naast je guide-RNA (CRISPR, red.) immers meerdere transcripten nodig voor de verschillende subunits, vaak ook nog eens in verschillende verhoudingen. Met gRAMP heb je maar één transcript voor één eiwit dat alles kan.’ Hij speculeert nog verder: ‘Stel dat het protease een specifieke peptidebinding als doelwit blijkt te hebben. Dan kun je heel nauwkeurig knippen als je een specifiek RNA-fragment aanbiedt. Daarmee heb je als het ware externe controle over je protease-activiteit. Je zou daarmee bijvoorbeeld een bio-actief molecuul in het lichaam kunnen activeren of deactiveren door er iets af te knippen. Op beide ideeën hebben we patentaanvragen lopen.’
CRISPR-Cas
In 2020 ging de Nobelprijs voor geneeskunde naar de ontdekking van CRISPR-Cas, een verdedigingsmechanisme van ééncelligen tegen virussen (bacteriofagen). Het is een tweedelig systeem: CRISPR (Clustered Regularly Interspaced Palindromic Repeats) vormt een genetische bibliotheek op basis van RNA van dergelijke indringers; Cas (CRISPR-associated system) is een min of meer variabel eiwitcomplex dat de virussen met zogenoemde protease-eiwitten in stukken knipt als hun DNA-sequentie overeenkomt met sequenties uit de CRISPR-bibliotheek. Biotechnologen gebruiken het als gereedschap om op een heel specifieke plek in DNA te knippen op basis van een sequentie in CRISPR.



















Nog geen opmerkingen