Namaak-eiwitfragmenten die precies op een ander eiwit passen en zo de groei van tumoren remmen, kun je tegenwoordig op de computer ontwerpen. Het bewijs (octrooi aangevraagd) is zojuist gepresenteerd in PNAS.
Het idee is dan dat je de interactie van je doel-eiwit met een ánder eiwit remt, en zo een signaalketen doorbreekt. Hoe lastig dat is, hangt deels af van de grootte van het contactoppervlak tussen die twee eiwitten. Soms is die bindingsplek zo klein dat je haar met een relatief simpel molecuultje kunt afschermen. Verreweg de meeste synthetische geneesmiddelen die zo’n interactie remmen, zijn tot nu toe van die simpele molecuultjes.
Maar in andere gevallen heb je te maken met twee tamelijk lange stukken eiwitketen die dankzij hun aminozuurvolgordes precies tegen elkaar passen, en waarbij verschillende aminozuurresiduen zorgen voor de onderlinge hechting. Dán zal je een inhibitor moeten vinden die één van die aminozuurvolgordes nabootst, en zichzelf ook nog in precies dezelfde vorm vouwt als die keten in het échte eiwit doet. Dat laatste is niet bepaald vanzelfsprekend, want zo’n vorm wordt grotendeels geforceerd door de rest van dat echte eiwit.
Onderzoekers van New York University en de University of Southern California hebben nu een procedure bedacht om zulke namaak-eiwitvormen (‘peptidomimetics’) te ontwerpen.
Om het aan te tonen maakten ze een cruciale alfa-helix na van HIF1alfa, een onderdeel van een transcriptiefactor die wordt aangestuurd door zuurstofgebrek. Die helix hecht zich daarbij aan een ander eiwit genaamd p300, en samen zetten deze twee eiwitten daarna een aantal genen aan die van pas komen in het notoir slecht doorbloede binnenste van een tumor.
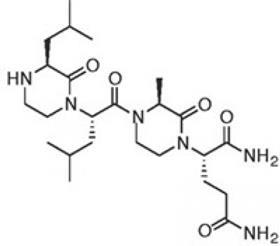
Het deel van die helix dat er toe doet bestaat uit zeven aminozuurresiduen, waarvan er vier (leucine op 818, leucine op 822, asparaginezuur op 823 en glutamine op 824) actief bij de binding aan p300 zijn betrokken. De Amerikanen sloegen dat asparaginezuur over en imiteerden de rest met een kortere keten van vier aminozuren. Die keten bogen ze vervolgens krom met extra koolstofketentjes die deze vier aminozuren omtoverden in twee oxopiperazine-ringstructuren.
Het resultaat is geen natuurgetrouwe kopie van de echte helix, maar de leucine- en glutamine-zijgroepen steken er wél op de juiste plekken en in de juiste hoeken uit en dat is waar het uiteindelijk om draait.
De onderzoekers hebben een paar varianten hiervan gemaakt. Een ervan bleek goed genoeg te werken om bij levende muizen de groei van tumoren met de helft te verminderen. Zo te zien was het middel zelf niet toxisch. Wordt ongetwijfeld vervolgd.
bron: University of Southern California















Nog geen opmerkingen