Fotoactiveerbare moleculen beginnen terrein te winnen binnen de farmacologie. Het zijn handige tools in de zoektocht naar nieuwe targets voor therapeutische interventie, maar ook de basis voor een innovatieve therapie bij kanker.
Vele bekende en nog te ontwikkelen medicijnen zou je zo kunnen aanpassen dat ze bij lichtbestraling ‘aan’ gaan en pas op dat moment biologisch actief worden. Zo kun je heel selectief en specifiek de plaats en tijd van biologische werking bepalen en daarmee vervelende bijwerkingen, waar bijvoorbeeld chemotherapie om bekend staat, vermijden.
Er bestaan twee typen lichtgevoelige verbindingen die als ‘lichtknopjes’ kunnen dienen: photocages en photoswitches. De eerste lijken op het oog het simpelst: je neemt een bioactief molecuul en zet daar een groep op die de werking ervan blokkeert, de zogenoemde cage. Bij photoswitches heb je daadwerkelijk het idee dat het ‘lichtknopjes’ zijn. Het betreft namelijk vaak lichtafhankelijke trans-cis-isomerie. Schijn je licht op dit soort isomeren dan ‘flipt’ het van de trans- naar de cis-vorm – en weer terug.
- Lichttherapie in de kliniek
- Photocage
- Extreem snelle terugflip
- Photoswitch
- Pionier Ben Feringa
- Trifunctionele lichtgeactiveerde moleculen
Lichttherapie in de kliniek
Al sinds eind vorige eeuw wordt in ziekenhuizen gebruik gemaakt van lichtgevoelige medicijnen. Het gaat dan om photodynamic therapy (PDT), dat onder meer voor huidaandoeningen en als behandeling van kanker wordt ingezet. Je injecteert de patiënt, waarna het medicijn zich verspreid door het lichaam, ook in de tumor. Daarna bestraal je alleen in de kankercellen de moleculen, die daardoor naar een verhoogd energieniveau gaan. Dat geeft zuurstofradicalen en die branden als het ware de tumor weg.
Klinkt ideaal, maar helaas kent PDT genoeg nadelen. ‘De voornaamste daarvan is dat het niet altijd werkt als er weinig zuurstof is’, vertelt Sylvestre Bonnet, hoogleraar fotochemie (Universiteit Leiden). ‘En laat dat nu net het geval zijn bij veel kankersoorten. Ook andere kankerbehandelingen, zoals immuuntherapie, hebben daar last van. Dat is een van de redenen dat photoactivated chemotherapy (PACT, red.) nu zoveel interesse wekt onder onderzoekers. In deze fototherapie speelt zuurstof geen rol.’

Photocage
‘De photocage verandert de chemische eigenschappen van je molecuul compleet, bijvoorbeeld door een lading toe te voegen, de hydrofobiciteit te veranderen of de vorm anders te maken’, verklaart Sylvestre Bonnet, hoogleraar fotochemie aan de Universiteit Leiden. ‘Pas wanneer je het molecuul bestraalt met licht, breekt het fragment eraf en kan het medicijn zijn werk doen.’
Bonnet en collega’s werken aan foto-geactiveerde chemotherapie (PACT). Daarbij maak je gebruik van al bestaande chemokuren, die je met licht kunt ‘uncagen’ en daarmee activeren binnenin de tumor. Bij het team van Bonnet gebeurt uncaging door middel van foto-substitutie, waarbij de caging-groep bij lichtbestraling wordt vervangen door het oplosmiddel, meestal water.
De caging-groep van Bonnet is een ruthenium-complex. In 2017 hadden hij en zijn collega’s deze verbonden aan een NAMPT-inhibitor. Daarbij hebben ze aangetoond dat activatie door middel van licht leidde tot het doden van tumorcellen in in vivo-experimenten, onafhankelijk van de zuurstofconcentratie. En recent nog hebben ze de ruthenium-photocage kunnen inzetten bij de microtubule-polymerisatie-remmer Rigidine (ontwikkeld in de groep van Alexander Kornieko in de VS). ‘Het zwavelatoom in dat medicijn bleek goed te binden met ruthenium’, zegt Bonnet. ‘Het eerste PACT-experiment in muizen ooit bleek daarna succesvol.’
Ook aan de KU Leuven zien ze heil in het gebruik van photocaging. Momenteel werken professor chemische biologie Steven Verhelst en zijn collega’s aan inhibitors van caspases, proteasen die verantwoordelijk zijn voor apoptose, ‘geprogrammeerde celdood’. ‘Caspases herkennen specifiek het negatief geladen aspartaat-residu in zijketens van zowel substraat als inhibitor’, legt hij uit. ‘Je kunt dit residu makkelijk maskeren door een photocage, waardoor de herkenning wordt verstoord en de inhibitor inactief is. Activatie vindt dan plaats bij bestraling.’ De photocage zelf bestaat uit een amideverbinding naar een nitroindoline.
Binnenkort wil de onderzoeksgroep de strategie in vivo gaan toepassen. ‘We gaan dan met transparante zebravis-embryo’s werken’, vertelt Verhelst. ‘Bij ontwikkelingsprocessen speelt apoptose een belangrijke rol in een tijds- en plaatsafhankelijke manier en met deze methode kunnen we mooie inzichten opdoen hierover.’
Het grote voordeel van het gebruik van photocages is dat je bioactieve molecuul al erg goed werkt. Je hoeft er – simpel gezegd – alleen nog maar een caging-groep op te zetten. Maar een groot nadeel is dat het proces irreversibel is; eenmaal geactiveerd kan je molecuul niet meer terug. En wanneer het dan uit de target-cellen diffundeert krijg je mogelijk elders problemen in het lichaam.
Extreem snelle terugflip
Een bijzonder type photoswitch is de iminothioindoxyl (ITI), een bijzonder molecuul ontwikkeld in de synthetische organische chemie-groep van het UMCG. De oorsprong was de verbinding thio-indigo, een bekende kleurstof én photoswitch. Maar vanwege zijn slechte wateroplosbaarheid, is het niet bruikbaar binnen de farmacologie. In 2016 wilde universitair hoofddocent Wiktor Szymanski en collega Mark Hoorens dat probleem oplossen door de dubbele koolstofbinding te vervangen door een dubbele stikstofbinding. ‘Helaas bleek het verkregen molecuul in onze uv-spectrometer niet te switchen’, vertelt Szymanski. ‘Het verdween in de kast en we keken er niet meer naar. Tot een jaar later tijdens het eerste internationale symposium over fotofarmacologie we ons realiseerden dat we het moesten proberen met geavanceerder apparatuur. Zo kwamen we terecht in het lab van Wybren Jan Buma aan de UvA. Daar bleek ITI wel degelijk een photoswitch, maar dan wel een extreem snelle: binnen 20 ms flipt het terug naar de stabiele vorm.’
De uitdaging is nu om de tijd tot het terugflippen uit te rekken. Dat proberen Szymanski en collega’s nu door de zijketens te veranderen. ‘Hiermee hebben we het al weten te rekken tot 70-100 ms. Berekening laat zien dat de ideale switchtijd voor farmacologische toepasbaarheid tussen 0,1 en 10 seconden ligt. We zijn heel dichtbij.’
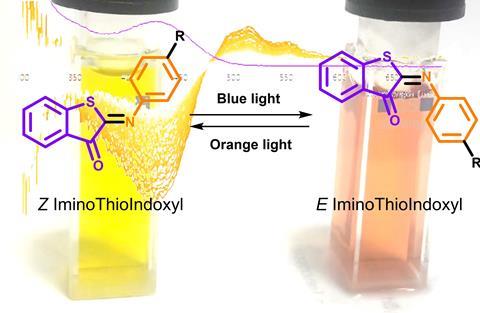
Photoswitch
Bij photoswitches heb je daadwerkelijk het idee dat het lichtknopjes zijn. Het betreft namelijk vaak lichtafhankelijke trans-cis-isomerie. Schijn je licht op dit soort isomeren, dan flipt het van de trans- naar de cis-vorm – en weer terug. Meer dan 80% van de tot nu toe ontwikkelde photoswitchbare moleculen bestaan uit een azobenzeen-achtige structuur (waarbij de dubbele stikstofbinding het centrum van de flip is). ‘Dat komt deels omdat azobenzenen stabiel en doorgaans makkelijk te synthetiseren zijn, al moeten er voor de syntheses van de moleculen wel wat praktische maatregelen getroffen worden (zie foto, red.)’, verklaart universitair docent medicinale chemie Maikel Wijtmans van de Vrije Universiteit Amsterdam.
Wijtmans toepassingsgebied is dat van de G-eiwit-gekoppelde receptoren (GPCR’s). Zo publiceerde het team in 2018 een photoswitch voor de CXCR3-chemokinereceptor, waarbij het ligand bij lichtbestraling verandert van antagonist naar agonist. Iets wat Wijtmans ‘vrij uniek binnen dit onderzoeksveld’ noemt. ‘In een eerdere ligandklasse ontdekten we een functionele hotspot: wanneer je gaat spelen met de positie van halogeenatomen aan de benzeenring, kun je de efficiëntie van je ligand sterk beïnvloeden. We bouwden vervolgens een photoswitch in en het met licht kunnen reguleren van de efficiëntie zagen we zelfs terug in experimenten met kikkeroöcyten.’ Ongepubliceerd in vivo-werk met een andere serie lichtgevoelige liganden, namelijk voor histamine-GPCR-eiwitten, laat inmiddels zien dat het gedrag van muizen reversibel kan worden beïnvloed met licht.
Met een photoswitch alleen ben je er natuurlijk niet. Je wilt hem ook nog verbinden aan een bioactief molecuul, zodat je daadwerkelijk je medicijn aan- en weer uit kan zetten door middel van licht. Bij een photocage is dit heel simpel; je maskeert alleen maar de groep die belangrijk is voor activiteit. Maar een photoswitch embedt je in een farmaceutisch relevant molecuul met de hoop dat de inhibitor in het donker inactief is, maar bij bestraling actief wordt. ‘Dit kun je natuurlijk aan het toeval overlaten, maar nog beter is dit via computermodellen na te gaan’, zegt Szymanski. ‘Dat kun je bijvoorbeeld via docking zien of je ligand daadwerkelijk pas ná de bestraling met licht in het corresponderende target-eiwit past. Heel recent zijn we hiermee begonnen met kinase-inhibitoren.’
Genoeg werk te verzetten nog dus binnen het veld van de fotofarmacologie. ‘Ik denk dat dit een heel levendig onderzoeksgebied is met een hoge coolness-factor. Licht is een fantastisch reagens, omdat je kan spelen met plaats, tijd en mate van activering van je ligand’, geeft Wijtmans aan. ‘Tien jaar geleden was dit nog een gek idee’, voegt Szymanski daaraan toe. ‘Maar nu zijn we bezig met te bewijzen dat het écht kan. We staan aan de vooravond van een soort licht-revolutie, daar ben ik van overtuigd.’
Pioneer Ben Feringa

Hoogleraar organische chemie Ben Feringa (RUG) staat vooral bekend om zijn ontdekking van lichtgevoelige moleculaire motoren, waar in 2016 de Nobelprijs voor ontving. Maar ook binnen de biologie en geneeskunde heeft hij zijn sporen verdiend. Zo ontwierp hij – in samenwerking met onder meer Wiktor Szymanski – al in 2011 lichtschakelaars voor antibiotica. Zo bleken lichtgevoelige fluoroquinolones ‘aangezet’ te kunnen worden op plekken waar de micro-organismes vertoefden, waarna er binnen twee uur een sterke toename was te zien in antibacteriële activiteit. Daarmee heeft Feringa de fotofarmacologie op de kaart gezet.
Trifunctionele lichtgeactiveerde moleculen
Ook in het buitenland staat fotofarmacologie inmiddels goed op de kaart. Zo heeft de Oostenrijkse hoogleraar chemie Dirk Trauner (New York University) vorig jaar in Science Advances een geheel nieuwe geneesmiddelenklasse beschreven: PHOTACs (photochemically targeting chimeras).
Deze zijn gebaseerd op PROTACs (proteolysis targeting chimeras), bifunctionele moleculen die met de ene kant binden aan het target-eiwit en met de andere kant met een zogenoemd ubiquitine-ligase, een onderdeel van het proteasoom. Het gevolg is dat het target-eiwit selectief wordt opgeruimd door het lichaamseigen degradatiesysteem. Dit komt goed van pas in ziektes waarbij er sprake is van te veel en/of defecte eiwitten.
Bij PHOTACs komt daar nog een schepje bovenop. Deze moleculen bevatten naast een ligand voor het target-eiwit en een ligand voor een ligase ook nog een photoswitch. Daarmee kun je deze met recht trifunctionele moleculen noemen. Bij bestraling van zo’n PHOTAC wordt het bioactief en zou het als geneesmiddel kunnen dienen. Trauner en zijn team toonden in een celcultuur aan dat het concept inderdaad werkt. Ze geven verder aan het PHOTACs een veelbelovend onderdeel kunnen gaan vormen voor de toekomstige fotofarmacologie.


















Nog geen opmerkingen