Kattenbakgrit, asfaltbeton en waspoeder hebben één ding gemeen – er zitten zeolieten in. Zeolieten zijn kristallijne, microporeuze aluminosilicaten. Ze hebben een intern netwerk van minuscule kanaaltjes, waardoor het beschikbare oppervlak per gram groot is. Op dat oppervlak kunnen moleculen adsorberen en reageren. De industrie gebruikt synthetische zeolieten als ionenwisselaars, katalysators en adsorbens. Die zeolieten zijn ontwikkeld om vooral aardolie en gas om te zetten, maar nu we zoeken naar andere grondstoffen, hebben we ook andere zeolieten nodig.
- ’Het is spannend, fundamenteel onderzoek’
- Ladingsverschil
- Impact in de industrie
- Moleculaire zeef
- Natuurlijke versus synthetische zeolieten
- Synthese en katalyse
- Cronstedt en zijn blaaspijp
‘Het is spannend, fundamenteel onderzoek’

Michiel Dusselier onderzoekt zeolieten aan de KU Leuven. Zijn onderzoeksgroep synthetiseert nieuwe zeolieten voor katalyse. Daarvoor proberen ze bijvoorbeeld om een tin- of titaniumatoom in te bouwen in het rooster, zodat het zeoliet zich als Lewiszuur gaat gedragen. Het is niet makkelijk om het titaniumatoom in het rooster te krijgen; als je teveel titanium inbrengt ontstaat er titaniumdioxide, of je verstoort het rooster.
Dusselier begon ooit met katalyse, waarbij hij commerciële zeolieten uit de kast gebruikte. Die paste hij aan en vervolgens gebruikte hij ze om nieuwe chemie uit te voeren. Dit veranderde toen hij een jaar aan het California Institute of Technology studeerde. Daar synthetiseerde hij alle structuren zelf. ‘Er was daardoor veel meer serendipiteit – er kon van alles uit de synthese komen, wat het extra spannend maakte’, zegt Dusselier.
We begrijpen de zeolietsynthese nog niet heel goed, en zeker niet die met organische moleculen als structuur-dirigerende agentia. ‘Het is soms nog een soort black box’, legt Dusselier uit. ‘Zeolietsynthese daardoor een speeltuin voor chemici en ingenieurs. Er zijn allerlei verschillende syntheseparameters en je weet niet precies wat eruit gaat komen. Het is spannend, fundamenteel onderzoek.’
De onderzoeksgroep van Dusselier gebruikt allerlei analysemethoden om te bepalen wat ze precies gesynthetiseerd hebben. Zo gebruiken ze XRD om de kristalstructuur te analyseren, porosimetrie om porie-eigenschappen zoals poriediameter en -volume te bepalen, stikstoffysisorptie om te bepalen hoeveel oppervlak er beschikbaar is, elementaire analyse om te bepalen welke elementen in welke verhouding in het rooster zitten en thermogravimetrie om te bepalen hoeveel water het zeoliet kan opnemen of hoeveel templaat er na de synthese in zit.
De andere helft van hun onderzoek is toepassing. ‘Als ingenieurs willen we in een relevante context werken. De combinatie synthese en katalyse heeft als groot voordeel dat we alle parameters voor synthese en daarmee de eigenschappen van de zeolietkatalysator zelf meer in de hand hebben’, aldus Dusselier. Zijn groep richt zich op drie substraten: CO2, biomassa en afval. Daaruit proberen ze met nieuwe katalytische processen nuttige producten uit te maken. ‘Oude chemie is gericht op de bewerking van olie en gas. Als je die bronnen wilt vervangen, moeten de zeolieten er ook anders uit zien. Biomassa bevat bijvoorbeeld veel zuurstof en olie niet, dus de zeolieten die je gebruikt om biomassa om te zetten hebben andere eigenschappen nodig.’
In 2022 synthetiseerden onderzoekers uit de groep van Dusselier en collega Ivo Vankelecom een membraan dat CO2 uit gasmengsels kan scheiden. Daarvoor combineerden ze een zeoliet met een polymeer (commercieel polyimide). Dat membraan presteerde beter dan alle bestaande polymeermembranen en zelf de meeste membranen die uit pure zeoliet bestaan. Ze publiceerden hun resultaten in december 2022 in Science.
Wat zijn zeolieten?
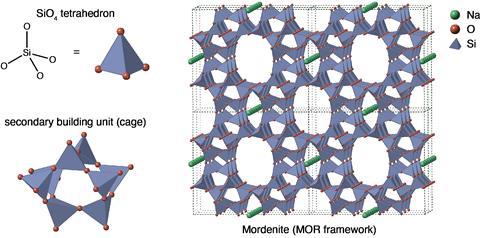
Zeolieten zijn kristallijne, microporeuze aluminosilicaten. Het zijn vaste materialen waarin de atomen in een bepaald patroon zijn gerangschikt, oftewel kristallijne materialen. Zeolieten bestaan uit siliciumatomen (Si), aluminiumatomen (Al) en zuurstofatomen (O) die in een tetrahedrale structuur gerangschikt zijn. Het silicium- of aluminiumatoom bevindt zich in het midden van de tetraëder en wordt omringd door vier zuurstofatomen. De algemene structuurformule van zo’n aluminosilicaat is TO2, waarin T het tetrahedrale atoom is, dus aluminium of silicium. Maar net als in de organische chemie kan één molecuulformule meerdere stoffen aanduiden, omdat de rangschikking van de atomen ten opzichte van elkaar anders is. Zo hebben zeolieten, als we enkel SiO2 beschouwen, bijvoorbeeld dezelfde molecuulformule als zand. De echte materiaaleigenschappen komen voort uit hoe de atomen ten opzichte van elkaar staan.
Zeolieten hebben heel veel poriën met een doorsnede van minder dan 2 nm en interne holtes. Door die poriën hebben zeolieten per gram materiaal veel intern oppervlak beschikbaar voor adsorptie en dus ook voor reacties op dat oppervlak. Het beschikbare oppervlak voor oppervlaktechemie per gram materiaal noemen we het specifiek oppervlak. Een zeoliet heeft al snel een specifiek oppervlak van enkele honderden m2 per gram materiaal.
Een belangrijke eigenschap van zeolieten komt voort uit het ladingsverschil tussen aluminium en silicium. Al is 3+, oftewel driewaardig, en Si is 4+, vierwaardig. De roosters zijn meestal silicarijk: er zitten meer siliciumatomen in dan aluminiumatomen. Als je een van de siliciumatomen vervangt door een aluminiumatoom, krijg je een ladingstekort. Dan ontstaat de kracht van een zeoliet: het heeft een positief geladen ion (kation) nodig om dit tekort te compenseren. Dat kan bijvoorbeeld met een natriumion, een kaliumion of een proton.
Impact in de industrie
We gebruiken zeolieten bijvoorbeeld als ionenwisselaar gebruikt in waspoeder, al is dat gebruik afgenomen nu we meer vloeibaar wasmiddel gebruiken. Ze kunnen water ontharden, doordat ze calciumionen (Ca2+) kunnen opnemen in hun structuur en in plaats daarvan (2) Na+-ionen vrijzetten. De industrie gebruikt ze om ionen te vangen. Als het zeolietrooster vol zit, kan het rooster geen extra ionen van dat type meer opnemen. Je moet het zeoliet dan regenereren in een overmaat van het gewenste tegen-ion door het terug in een geconcentreerde zoutoplossing brengen om de opgenomen ionen eruit te halen en het rooster opnieuw bruikbaar te maken.
Een andere belangrijke toepassing is als katalysator. Zeolieten zijn om talloze redenen geschikt als katalysator, maar de belangrijkste drie zijn hun beschikbare oppervlak, hun vormselectiviteit en hun robuustheid. Zeolieten hebben zoals eerder gezegd een enorm intern oppervlak. Als dat allemaal kunt gebruiken, heb je veel plaatsen waar moleculen kunnen adsorberen en dus beschikbaar zijn voor oppervlaktechemie. Op nanoschaal ziet een zeoliet eruit als een wirwar van kanalen en gaatjes. De vorm van die kanalen bepaalt welke moleculen in het zeoliet kunnen diffunderen en dus kunnen reageren op het katalysatoroppervlak: vormselectiviteit.
De industrie gebruikt veel zeolietkatalysators. Zeolieten zijn robuust en sterk, wat een groot voordeel is voor een industriële toepassing. Ze kunnen hoge temperaturen en zuurstof weerstaan en blijven bij 500 tot soms zelfs 900°C in de oven intact. Je kunt het katalyseproces dus op zeer hoge temperatuur uitvoeren, zonder dat het zeoliet beschadigt. Het biedt ook een veiligheidsvoordeel: je kunt een zure zeoliet bijvoorbeeld gebruiken als katalysator in plaats van een vloeibaar zuur. Een vloeibaar zuur is bijtend, maar een vaste zeoliet kun je met je handen vasthouden.
Moleculaire zeef

Door de vormselectiviteit en het grote specifieke oppervlak kun je zeolieten gebruiken als moleculaire zeef, die heel gericht bepaalde moleculen kunnen laten plakken. Er vindt dan geen reactie plaats, maar sommige moleculen zullen vanuit het mengsel in het zeoliet gaan zitten, terwijl andere in het mengsel blijven. Achteraf kun je deze moleculen weer uit het zeoliet halen, bijvoorbeeld door lichte verhitting of een onderdruk. Zo gebruiken sommige industriële processen zeolieten om water te verwijderen en grote stromen te drogen. Watermoleculen zijn relatief klein en passen wel in het zeoliet, dat vaak ook nog hydrofiel is. Dit is te vergelijken met silicabolletjes in nieuwe koffers of schoenen: die kunnen selectief water absorberen en zo de stof drooghouden.
In theorie zijn er 260.000 zeolietstructuren mogelijk. Hiervan zijn tot nu toe 255 structuren ontdekt of gesynthetiseerd. 18 van deze structuren worden daadwerkelijk gebruikt in de industrie. Alle bekende zeolieten hebben een eigen unieke drielettercode. Zo duiden we stilbiet aan met STI, chabaziet met CHA en faujasiet met FAU.
Natuurlijke versus synthetische zeolieten
De eerste bekende zeolieten komen uit de natuur. Het zijn natuurlijke oxidemineralen van aluminium en silicium, zoals erioniet, faujasiet en gmeliniet. Deze materialen zijn familie van klei. Klei bestaat uit tweedimensionale laagjes en behoort technisch gezien tot de groep fyllosilicaten, terwijl zeolieten de driedimensionale tectosilicaat-variant van deze stof zijn. Natuurlijke zeolieten zijn over het algemeen goedkoper. Ze hebben minder specifiek oppervlak en kristalgroei in de natuur duurt vaak lang. Het is een geologisch proces dat eeuwen duurt. Als er tijdens die jaren een fout ontstaat in de kristalgroei, kan het kristal zo groeien dat de kanalen geblokkeerd raken. Dan kun je het geblokkeerde interne oppervlak niet meer bereiken en dus niet meer gebruiken.
Meestal zit er meer aluminium in natuurlijke zeolietroosters, ook al gaan die aluminiumatomen in het rooster nooit naast elkaar zitten. Het maximale mol-percentage aluminium (als percentage van de tetrahedrale silicium- en aluminiumatomen) is dan ook 50%. Dit zijn zeer hydrofiele roosters. Roosters met meer silicium worden geleidelijk hydrofober, alhoewel dit ook afhangt van de kationen en de perfectie van de kristalstructuur. Zeolieten die de industrie gebruikt voor wateradsorptie hebben een hoger percentage aluminium, terwijl die voor katalyse meestal minder aluminium bevatten. Een rooster zonder aluminium kan erg hydrofoob zijn.
De eerste synthetische zeolieten werden in de jaren vijftig gemaakt. Voor katalyse en hoogwaardige toepassingen gebruiken chemici liever synthetische zeolieten, omdat ze dan meer controle hebben over de samenstelling en poriegrootte. Natuurlijk zeoliet winnen we uit gesteentes. Het is meestal vervuild met andere chemische elementen en moeilijk zo aan te passen dat het de gewenste eigenschappen heeft. Daarom is de waarde per massa bij synthetische zeolieten hoger dan bij natuurlijke zeolieten.

Synthese en katalyse
Een groot deel van het zeolietonderzoek gaat over katalyse. Synthese lijkt op de tweede plek te staan. Katalytici kunnen gemakkelijk commerciële zeolieten aankopen en passen die bijvoorbeeld zo aan dat ze de gewenste reactie katalyseren. Als je katalytisch onderzoek en synthetisch onderzoek combineert heb je als onderzoeker meer speelruimte. Je kunt dan roosters testen die de gemiddelde katalyticus niet kan maken.
Een chemicus maakt zeoliet uit een bron van silica en aluminium (bijvoorbeeld een aluminiumhydroxide), een templaat, kationen en een mineraliserend agens. Een templaat is een molecuul dat ongeveer even groot is als de gewenste poriegrootte. Soms past het perfect en vormt het zeoliet er omheen. Vaak is het echter geen één op één verband en kun je het beter een structuur-dirigerend agens noemen. Het hydroxide anion (OH-) kan bijvoorbeeld als structuur-dirigerend agens dienen. Hydroxide katalyseert het breken en vormen van de binding tussen silicium of aluminium en zuurstof. In de natuur doet een zeoliet er jaren over om te groeien, maar chemici kunnen het in het laboratorium doorgaans binnen een week. Soms zelfs binnen enkele uren.

Cronstedt en zijn blaaspijp

Het woord zeoliet is waarschijnlijk bedacht door de Zweedse mineraloog Axel Fredrik Cronstedt in 1756. Hij zag dat de natuursteen stilbiet ging stomen als hij deze verhitte. Het woord zeoliet komt dan ook van de Griekse woorden ζέω (zéō), wat koken betekent en λίθος (líthos), wat steen betekent: een kokende steen. De steen zelf kookte natuurlijk niet. Er was water geadsorbeerd op het interne oppervlak van de steen en dat verdampte bij verhitting, waardoor de steen ging stomen.
Axel Fredrik Cronstedt (1722-1765) was naar verluid de eerste chemicus die een blaaspijp gebruikte voor systematische analyse van mineralen. De blaaspijp werd daarvoor vooral gebruikt door goudsmeden om minuscule puntjes in sierraden te verhitten en te solderen. Met een paar aanpassingen was dit instrument ook geschikt om de bestanddelen van kleine ertsmonsters te identificeren. Een onderzoeker gebruikte een koperen buis om een luchtstroom door een vlam te blazen en zo een specifiek deel van het testobject te verhitten. Door de positie van de blaaspijp in de vlam te variëren kon de onderzoeker het object met een oxiderende of reducerende vlam behandelen. De onderzoeker noteerde het smelt-, sublimatie- en ontleedpunt en kleurveranderingen in het sample en in de vlam. Omdat deze instrumenten relatief klein en draagbaar waren, konden chemici ze thuis, op het lab of in het veld gebruiken.
Cronstedt analyseerde alle mineralen waar hij toegang toe had. Eén daarvan was aluminosilicaat, dat hij zeoliet noemde. Verschillende mineralogen ontdekten gezamenlijk elf nieuwe elementen met de blaaspijp. Cronstedt was de eerste. Hij publiceerde in 1751 dat hij een nieuwe component had ontdekt. In 1754 noemde hij de component nikkel, naar het Duitse woord Kupfernickel (koperduivel).
















Nog geen opmerkingen