Een van de meest bekende chemische reactiemechanismes – de SN2-substitutie – verloopt soms heel anders dan je zou verwachten, blijkt uit kwantumchemische modellen van een Leids-Amsterdams team.
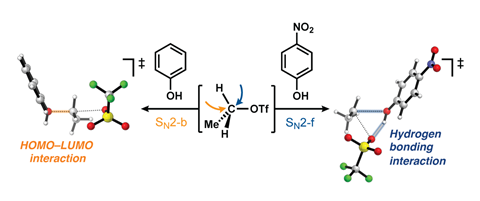
Dit chemische reactiemechanisme leer je tegenwoordig al in de bovenbouw van de middelbare school: de bimoleculaire nucleofiele substitutiereactie (SN2), waarin het aanvallende deeltje (nucleofiel) het substraat (elektrofiel) van de achterkant aanvalt en de vertrekkende groep op vrijwel hetzelfde moment het substraat verlaat (zie afbeelding onder). Wouter Remmerswaal, Jeroen Codée, Thomas Hansen en collega’s zagen bij hun experimenten acht jaar geleden echter reactieproducten ontstaan die niet via dit mechanisme te verklaren zijn. Ze hebben nu eindelijk een deel van de puzzel gelegd, laten ze zien in Chemistry – A European Journal.
‘In 2016 deed Wouter zijn masterstage in het lab van Jeroen aan de Universiteit Leiden, waar ik toen AIO was’, vertelt Thomas Hansen, universitair docent aan de Vrije Universiteit Amsterdam. ‘We waren daar bezig met complexe substitutiereacties en kwamen resultaten tegen die we tot op heden niet helemaal kunnen verklaren.’
Het project kwam uiteindelijk tot stilstand, totdat de onderzoekers zo’n drie jaar geleden de draad weer oppikten. ‘We versimpelden de reacties en stopten ze in de computer’, vervolgt Hansen. ‘Toen we opnieuw keken naar die substitutiereacties bleek de traditionele SN2-reactie niet altijd het meest gunstige mechanisme; soms komt het nucleofiel niet van de achterkant, maar juist vanaf de voorkant. Dat is iets waar we in 2016 niet bij stilstonden, maar wat mogelijk wel het plaatje completer maakt.’
Backside vs. frontside
Specifiek keken ze naar kwantumchemische modellen van nucleofiele substituties tussen fenolen en alkyltriflaten en hoe de ‘normale’ backside variant (SN2-b) zich verhoudt tot de minder voorkomende frontside variant (SN2-f). Hoogleraar organische synthese Jeroen Codée: ‘We leren onze studenten dat SN2 áltijd van de achterkant komt, dus dan sta je niet echt stil bij de optie dat het ook vanaf de andere kant kan. Maar bij deze modelreacties zien we dat het best logisch is dat het nucleofiel van de voorkant kán komen, omdat de alcoholgroep zijn proton direct aan de vertrekkende groep kan afgeven.’
De frontside SN2 komt niet uit de lucht vallen. Remmerswaal vertelt dat je dit mechanisme ook veel terugziet bij enzymen en ook in de (oude) literatuur zie je dat meer transformaties hier last van hebben. Bij de SN2-b is er sprake van inversie van de stereochemie, waar je bij de SN2-f juist dezelfde stereochemie houdt (retentie). Bij solvolysereacties, waarin het oplosmiddel een SN2-reactie doet, zie je verrassend veel retentie, wat op de SN2-f lijkt te wijzen.
Trends
De onderzoekers vonden twee duidelijke trends die te maken hadden met enerzijds de substitutiegraad van het elektrofiel en anderzijds de sterkte en zuurgraad van het alcohol-nucleofiel. ‘Een elektrofiel met meer substituenten en een zwakker nucleofiel sturen naar de frontside’, legt Hansen uit. ‘Als het elektrofiel meer groepen om zich heen heeft, kan er meer carbokationisch karakter worden opgebouwd tijdens de substitutie reactie. Zo kan de vertrekkende groep ruimte maken voor het nucleofiel.’
Voor het nucleofiel geldt: hoe zwakker, hoe zuurder. Oftewel, een zwak elektrofiel kan zijn proton makkelijker afstaan, en dat is weer interessant voor de vertrekkende groep, aangezien die daar daardoor wordt gestabiliseerd en eerder vertrekt. Bij de frontside speelt de waterstofbruginteractie tussen alcohol en vertrekkende groep dus een grote rol.
Het blijft niet bij kwantumchemie, want de chemici brengen deze modellen ook in de praktijk. ‘We kijken nu naar een aantal reacties waarbij de frontside een realistisch scenario lijkt’, aldus Codée. ‘Maar voor we daarmee naar buiten treden willen we eerst een stevigere experimentele basis hebben. Er is nog een heleboel niet duidelijk, maar uiteindelijk wil je de hele wisselwerking tussen standaard SN2, SN1 en SN2 frontside in kaart kunnen brengen en daarmee voorspellingen kunnen doen over wat er gebeurt in substitutiereacties.’
Tekstboeksubstituties
Remmerswaal: ‘Het lastige met dit soort onderzoek is ook dat als je het ene puzzelstukje hebt gevonden en snapt hoe die moet liggen er toch weer andere puzzelstukjes van onder het tapijt komen. Die lijken er dan stiekem bijgelegd te worden, wat het proces niet makkelijker maakt.’
Al met al ‘zijn tekstboeksubstituties dus niet per se wat ze lijken’, zegt Codée. ‘Het is weer een voorbeeld dat we er nog lang niet zijn.’ Hansen concludeert: ‘Ook al is de SN2 de meest simpele organische reactie, het is tevens ook de meest complexe.’
Remmerswaal, W. et al. (2024) Chem. Eur. J. e202400590, DOI: 10.1002/chem.202400590




















Nog geen opmerkingen