Alkylgroepen rondom een koolstofatoom maken het instabieler, waardoor het resulterende carbokation relatief stabieler wordt. Dit gegeven wordt ten onrechte over het hoofd gezien, schrijven Amsterdamse theoretisch chemici in Chemical Communications. Tegelijkertijd wijzen ze op het gevaar van het gebruik van isodesmische reacties.
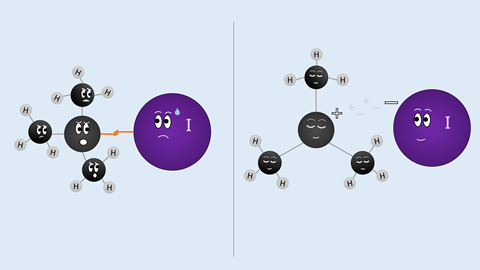
Carbokationen zijn reactieve intermediairs in de organische chemie die je veel ziet bij fundamentele synthetische reacties. Deze reactieve deeltjes ontstaan over het algemeen door het breken van een C–X binding, bijvoorbeeld koolstof-halogeenverbindingen zoals R3C–I of R3C–Cl. Tot op heden dacht men dat die C–X-binding minder sterk werd als je steeds meer alkylgroepen aan het koolstofatoom toevoegt, omdat hierdoor de stabiliteit van het carbokation zou toenemen. ‘Dat is zeker niet incorrect’, zegt Thomas Hansen van de Vrije Universiteit Amsterdam. ‘Het geeft alleen niet het complete beeld, er zit meer achter.’ Hansen publiceerde het complete beeld in Chemical Communications met Pascal Vermeeren, Matthias Bickelhaupt en Trevor A. Hamlin, alle drie verbonden aan dezelfde universiteit. Recent haalde het artikel zelfs de cover.

Hansen en zijn collega’s laten zien dat het belangrijkere effect in het uitgangsmolecuul plaatsvindt: door steeds meer alkylgroepen (in dit geval methylen) toe te voegen aan R3C–X wordt het geheel minder stabiel. Dát is de drijvende kracht achter de stabilisatie van het carbokation, wat volgens de groep tot dusver volledig over het hoofd werd gezien. ‘De hyperconjugatie tussen het kation en de substituenten is ook belangrijk, maar levert niet de grootste bijdrage’, benadrukt Hansen.
Om te bevestigen dat de repulsie in het startmolecuul zorgt voor de instabiliteit van de C–X-binding, deed Hansen berekeningen aan een thermodynamische cyclus van de dissociatie van R3C–X naar R3C+ + X– (zie schema hier onder). ‘In de berekening breek je eerst de substituenten van het centrale koolstofatoom af’, legt hij uit. ‘Vervolgens kun je vergelijken hoe de enthalpie verandert als je steeds meer alkylsubstituenten toevoegt, hier dus methylgroepen. Dat doe je dan voor zowel het startmolecuul als het carbokation. Uit die vergelijking kwam naar voren dat het startmolecuul destabiliseert en het carbokation juist stabiliseert. Maar de stabilisatiefactor is in dit geval minder groot dan de destabilisatiefactor.’
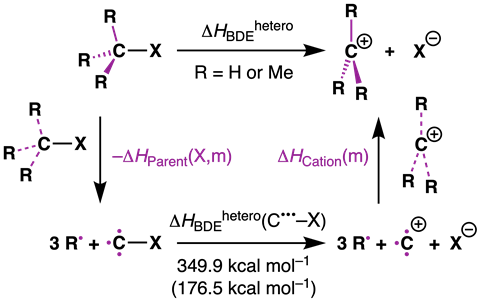
Trevor A. Hamlin wijst op hun recente onderzoek naar radicaalstabiliteit (waar we al eerder over schreven): ‘De methylgroepen stabiliseerden het radicaal dat ontstond na het splitsen van de C–X-binding juist helemaal niet, maar zorgden voor instabiliteit. Het carbokation wordt wel door de methylgroepen gestabiliseerd, maar dat is dus niet de leidende term.’
Gevaar van isodesmische reacties
Waarom deze factor zo lang over het hoofd werd gezien, komt door het gebruik van isodesmische reacties. Dat zijn reacties waarin je voor en na de reactie hetzelfde aantal bindingen van gelijke aard hebt, bijvoorbeeld C–C-, C–H- en C–X-bindingen, zoals in H3C–X + R3C+ → H3C+ + R3C–X. Je berekent dan de bindingsenthalpieën voor en na de reactie en legt die vervolgens naast elkaar. Hamlin: ‘Wat veel mensen en tekstboeken over het hoofd zien is dat er in isodesmische reacties meer dan één deeltje de stabiliteit van het systeem bepaalt. Leraren en onderzoekers hebben de neiging om enkel op de reactieve, “interessantere” deeltjes te focussen in deze isodesmische reacties en dus het “saaiere” deeltje over het hoofd zien dat in dit geval de beslissende rol heeft in het systeem.
Dit bevestigt ook Matthias Bickelhaupt. ‘Isodesmische reacties komen veel voor omdat ze vrij makkelijk zijn. In het lab trek je niet zomaar een methylgroep van een koolstofatoom; dat hoeft ook niet in zo’n vergelijking. De methode zelf is ook niet verkeerd, maar de interpretatie ervan wél, en dan met name de aanname dat trends en effecten alleen uit de ionen komen. Dat misverstand moet de wereld uit.’ Bickelhaupt benoemt ook dat hier vaak helemaal niet bij stil wordt gestaan. ‘In papers zie je hier ofwel niks over, of er wordt impliciet iets foutiefs aangenomen, of de verkeerde aanname wordt zelfs expliciet genoemd. En vervolgens gaat de interpretatie noodgedwongen mis.’
‘Daarom zijn we blij met de berekeningen van Thomas’, vult Hamlin aan. ‘Vroeger was het erg moeilijk om zo’n thermodynamische cyclus door te rekenen, maar Thomas is het gelukt om dat op een eenvoudigere manier te doen. Nu kunnen we stapsgewijs kijken naar de juiste bindingen.’
Hansen, T. et al. (2022) Chem. Commun. 58, 12050-12053, doi.org/10.1039/D2CC04034D















Nog geen opmerkingen