De groep van Matthias Bickelhaupt (VU Amsterdam) zet wéér een algemeen geaccepteerd ‘feit’ in de (fysische) organische chemie op z’n kop: methylradicalen worden niet gestabiliseerd door meer substituties, maar juist gedestabiliseerd. Het bewijs leveren ze in Angewandte Chemie.
Eerder schreven we al over paradigmashifts in de bindingslengte en bindingssterkte van C-H-bindingen, maar de groep van Bickelhaupt zit niet stil. Ze leggen de bijl nu aan de wortels van een vrij bekende vuistregel in de organische chemie, namelijk dat hoe meer gesubstitueerd een methylradicaal is (in de vorm MemH3-mC∙, met m = 0-3), hoe stabieler die zal zijn. Dit zou dan ook de reden zijn voor het verzwakken van de C-H-binding van het alkaan MemH3-mCH bij een hogere substitutie. Eva Blokker en collega’s van de Vrije Universiteit Amsterdam dragen bewijs aan dat de eerste bewering niet klopt, terwijl de tweede bewering standhoudt.
Bickelhaupt liep al langer met dit idee rond, vertelt PhD’er Eva Blokker. ‘Hij had altijd al het idee dat methylsubstituenten op koolstofradicalen ook zouden leiden tot sterische repulsie van het radicaal, wat het radicaal dus minder stabiel zou maken.’ De tekstboekuitleg dat een meer gesubstitueerd radicaal stabieler zou zijn leek in Bickelhaupts ogen niet te kloppen.
Die gedachte besloot hij met zijn team te testen. ‘We bekeken beide kanten van de reactie’, legt Blokker uit. ‘Dus zowel het parent molecule als het gevormde radicaal, en alle stappen daartussenin. We braken ze op met DFT-berekeningen (M06-2X/TZ2P, red.) en energy decomposition analyses en keken naar de stabilisatie dan wel destabilisatie van de verschillende stappen in de reacties.’ Zie ook het schema hieronder. Waar de observaties op neerkomen is dat het alkaan en het corresponderende radicaal dezelfde trend volgen: hoe meer methylsubstituenten, hoe meer gedestabiliseerd beide moleculen zijn, waarbij het radicaal minder gedestabiliseerd is dan het origineel.
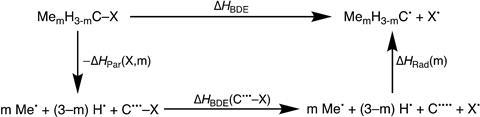
De reden achter de destabilisatie is simpel, aldus Blokker: ‘De binding naar een methylgroep is zwakker dan de binding naar het oorspronkelijke waterstofatoom, en daarnaast is er sterische repulsie tussen de methylsubstituenten. De reden dat de destabilisatie groter is bij het alkaan komt omdat die sterisch voller zit (coördinatiegetal van het centrale koolstof is 4), waardoor de toename in methylsubstituenten direct ook meer destabilisatie oplevert .’
De relevantie van dit onderzoek zit hem allereerst natuurlijk in de fundamentele kennis over radicalen, maar ook in praktische zin kan deze kennis helpen. Blokker: ‘In mijn PhD-project werken we samen met chemiebedrijf Nouryon. We denken mee over polymeerchemie; specifiek ontwerpen we voor hen nieuwe polymerisatie-initiatoren. Als je een zo reactief mogelijk radicaal wilt hebben, is het handig om iets over de instabiliteit te weten.’
De volgende tekstboekbladzijde die de groep van Bickelhaupt langzaam aan het losscheuren is, gaat over captodatieve radicalen. Op de hoogte blijven? Zorg dan dat je onze nieuwsbrief ontvangt en de site in de gaten houdt!
Blokker, E. et al. (2022) Angew. Chem. Int. Ed., e202207477, doi.org/10.1002/anie.202207477















Nog geen opmerkingen