Vlaamse en Italiaanse onderzoekers hebben een strategie ontwikkeld om de werking van een enzym dat verstoord is in de ziekte van Parkinson te herstellen. In Nature Communications laten ze zien hoe fragmenten van afweerstoffen precies op de juiste plek aan het enzym kunnen binden om het te stabiliseren en de activiteit te versterken.
Parkinson is een neurodegeneratieve ziekte waarbij de lichamelijke motoriek achteruit gaat. Dit zorgt voor trillende spieren, moeizame beweging en evenwichtsproblemen. Hoewel wereldwijd tien miljoen mensen aan de ziekte lijden, is er nog steeds geen geneesmiddel voor en blijft de oorzaak in vele gevallen onbekend. Wel is duidelijk dat mutaties van het enzym glucocerebrosidase (GCase), dat specifieke lipiden afbreekt, een belangrijke rol spelen in de ziekte. Door de verstoorde werking van het enzym hopen onafgebroken afvalstoffen zich op in de cellen, wat als risicofactor voor Parkinson geldt.
Nu hebben twee onderzoeksgroepen, geleid door Wim Versées van het VIB-VUB Centrum voor Structurele Biologie uit Brussel en Nicoletta Plotegher van de Universiteit van Padova, een nieuwe strategie ontwikkeld om de werking van GCase te beschermen en te herstellen. Dit deden ze door nanobodies – kleine, stabiele stukjes van speciale antilichamen – met uiterste precisie aan het enzym te laten binden. Versées: ‘De nanobodies stabiliseren de structuur en werking van het enzym. Ook hebben we enkele nanobodies ontdekt die de werking van gemuteerd GCase konden herstellen.’
Kameelachtige antilichamen
Mutaties kunnen ervoor zorgen dat GCase tijdens de reis door de cel ontvouwt en vast komt te zitten, waardoor de cel afsterft. Deze nadelige effecten zijn te voorkomen met zogeheten ‘moleculaire begeleiders’ (molecular chaperones) die aan het enzym binden om de vorm en functie te beschermen of zelfs te herstellen. Een probleem is dat traditionele moleculaire begeleiders ongewenst kunnen binden aan de active site van GCase, waardoor het zijn functie verliest.
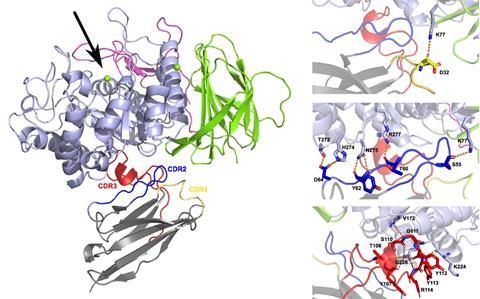
Nanobodies vormen een geschikte kandidaat als moleculair begeleider, aangezien ze relatief eenvoudig te ontwerpen zijn om niet aan de active site van het enzym te binden. De nano-eiwitten zijn stukjes van unieke antilichamen die oorspronkelijk in kameelachtigen voorkomen. Waar menselijke antilichamen meerdere domeinen nodig hebben om te binden, bezitten die van onder andere kamelen en lama’s slechts een enkel bindend domein. ‘Dat domein kan onafhankelijk geproduceerd worden en functioneren, en vormt zo een nanobody’, zegt Versées. ‘Door hun eenvoud zijn ze veel makkelijker in grote hoeveelheden aan te maken dan menselijke antilichamen. Daarnaast bezitten de nanobodies lange lussen, waarmee ze beter kunnen doordringen in kleine inhammetjes op het oppervlak van eiwitten om daar te binden.’
De onderzoekers ontwikkelden meerdere nanobodies die aan GCase konden binden. Toen ze de affiniteit en stabiliteit analyseerden, zagen ze dat sommige varianten door hun binding voorkwamen dat het enzym kon ontvouwen. Ook bleken enkele nanobodies de activiteit van het enzym te verhogen.
Bindingsaffiniteit
Gedeelde eerste auteurs Thomas Dal Maso (VIB-VUB) en Chiara Sinisgalli (Universiteit van Padova) voerden het gros van de experimenten uit. Waar Sinisgalli in Italië de werking van de nanobodies in cellen onderzocht, richtte Dal Maso zich op de biochemische karakterisatie van de verschillende nanobodies.
Dal Maso mat onder andere de bindingsaffiniteit tussen de nanobodies en GCase op zoek naar de juiste condities. ‘We bedekten een oppervlak met een type nanobody en lieten hier licht doorheen schijnen’, zegt hij. ‘Als de GCase in de toegediende vloeistof vervolgens bond aan deze nanobodies, veranderde de brekingsindex van het oppervlak, waardoor we de affiniteit konden uitlezen.’ Interessant genoeg ontdekte hij een nanobody die een zeer lage affiniteit vertoonde, maar de activiteit van het enzym wel het meest versterkte. Dal Maso: ‘Nu willen we de affiniteit van deze nanobody verhogen, waardoor de werking nog meer zou moeten toenemen.’
Barrière
Uiteindelijk hopen de onderzoekers deze resultaten toe te kunnen passen als praktische therapie. ‘Maar dat is voorlopig nog niet aan de orde’, zegt Versées. ‘Eerst moeten we nog heel veel dingen testen in muismodellen en patiëntcellen in het lab, vooraleer we de nanobodies aan patiënten kunnen geven.’
Daarnaast vormt de hersenbloedbarrière, de grens tussen onze bloedsomloop en de hersenen, een grote uitdaging. De stukjes eiwitten zijn te groot om door de blokkade heen te dringen, waardoor ze niet bij de hersencellen kunnen komen waar ze nodig zijn. Versées: ‘Daarom zoeken we nu naar technieken die de nanobodies het brein in kunnen shuttelen, bijvoorbeeld door ze door een onschadelijk virus mee te laten nemen.’
Dal Maso, T., Sinisgalli, C. et al. (2025) Nat. commun. 16(4890), DOI: 10.1038/s41467-025-60134-4




















Nog geen opmerkingen