Sterische afstoting is belangrijk om het bindingsvormingsproces in moleculen te begrijpen, want je substituenten spelen misschien een grotere rol dan je zou denken, meldt een Amsterdamse groep in Chemical Science.
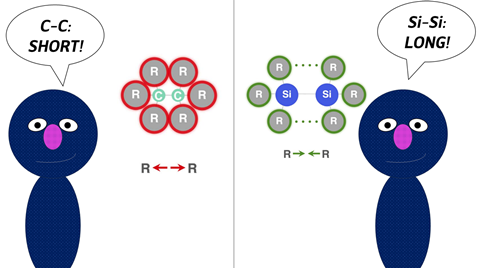
Er zijn maar weinig chemische bindingen die grondiger zijn onderzocht dan de koolstof-koolstof (C–C) -binding. Daarom komt het niet als een verrassing dat je sommige bindingsconcepten intuïtief oppikt. Neem bijvoorbeeld het effect van de grootte van substituenten op de C–C-binding. Hoe groter de substituenten, hoe minder stabiel de binding is. Maar tot op zekere hoogte geldt het omgekeerde effect voor Si–Si-bindingen: grotere substituenten resulteren in een sterkere binding tussen de siliciumatomen. Hoe komt dat? Daniela Rodrigues Silva, Eva Blokker, Matthias Bickelhaupt en collega’s van de Vrije Universiteit Amsterdam onderzochten deze vraag in een samenwerking met Nouryon.
‘De resultaten lijken op het eerste gezicht misschien niet verrassend omdat dit concept heel intuïtief is, maar toch wordt het nog vaak over het hoofd gezien’, zegt Daniela Rodrigues Silva, postdoc in de Amsterdamse TheoCheM-groep. Als onderzoekers het hebben over chemische bindingen, hebben ze de neiging om deze alleen te benaderen in termen van de sterkte van de elektronenpaarbinding die wordt gevormd en zien ze het effect van sterische afstoting niet, legt ze uit. ‘Om het effect van de grootte van de substituent te begrijpen, is het belangrijk om eerst te kijken naar de intrinsieke sterkte van de onderlinge groep-14 element-elementbindingen. De Si–Si-binding is zwakker dan de C–C-binding vanwege de toename in atoomgrootte en dus toename in sterische afstoting.’ Dit effect is ook te zien bij koolstof-halogeenbindingen, zoals Eva Blokker eerder liet zien. ‘Deze trend geldt ook voor andere homodiatomische bindingen.’
Met DFT-berekeningen en kwantumchemische simulaties wilde de groep dit concept doorgronden. Ze modelleerden R3C–CR3 en R3Si–SiR3, waarbij R3 = H3 (klein), Me3, Me2Ph, MePh2, Ph3 of t-Bu3 (groot). Rodrigues Silva: ‘Onze belangrijkste conclusie was tweeledig: ten eerste is sterische afstoting erg belangrijk om het proces van bindingsvorming te begrijpen, en ten tweede kunnen dezelfde substituenten tegengestelde effecten hebben, afhankelijk van het centrale atoom waaraan ze zijn bevestigd.’
Sterische aantrekking
Ze illustreerden dit in de C–C en Si–Si-bindingen. ‘Groepen rond koolstof liggen dichter bij elkaar en zijn daarom sterisch nogal opgekropt’, vervolgt Rodrigues Silva. Silicium is echter groter en heeft langere bindingen, dus de substituenten voelen elkaar veel minder aan, waardoor sterische afstoting verandert in sterische aantrekking. Hierdoor wordt de Si–Si-binding sterker. De afstoting neemt verder af naarmate je lager in het periodiek systeem komt, tot het punt waarop de binding ongevoelig wordt voor de grootte van de substituenten. Dit geeft ons de kennis om de sterkte van de binding naar believen af te stellen.’
Dat de Si–Si-binding sterker wordt, heeft te maken met ‘sterische aantrekking’ of ‘dispersie’. ‘Sterische aantrekking is een minder gebruikelijke term dan dispersie, maar het benadrukt het grootte-effect’, zegt de postdoc. ‘De zogenoemde sterische aantrekking bestaat uit stabiliserende vanderwaalsinteracties die de sterische afstoting overwinnen wanneer de substituenten fysiek verder van elkaar verwijderd zijn.’
De onderzoekers ontdekten ook dat de C–Si-binding gedrag vertoont dat tussen de C–C-bindingen en Si–Si-bindingen in ligt. Grotere substituenten op C–C veroorzaken een zwakkere binding; op Si-Si veroorzaakt het eerst sterkere bindingen tot R=Ph3, daarna, voor t-Bu3, wordt de binding zwakker; voor C–Si veroorzaken grotere substituenten ook zwakkere bindingen, maar niet in dezelfde mate als bij C-C.
‘Ons uiteindelijke doel is om te begrijpen waarom deze dingen gebeuren’, concludeert Rodrigues Silva. ‘Vervolgens willen we deze kennis gebruiken en koppelen aan specifieke toepassingen. Ook in onze samenwerking met Nouryon passen we nieuwe bindingsmodellen toe, zij het voor heel andere soorten systemen.’
Rodrigues Silva, D. et al. (2024) Chem. Sci., DOI: 10.1039/D3SC06215E
Radial nodes
Voor de diehards: het ligt nog nét even ingewikkelder. ‘Als we het over covalente bindingen hebben, denken we natuurlijk aan de vorming van elektronenparen’, zegt Rodrigues Silva. ‘In het periodiek systeem wordt de element-elementbinding zwakker door sterische afstoting tussen de grotere atomen, terwijl de elektronenpaar-bindingsorbitaalinteracties sterker worden. Waarom is dat zo? Eén van de redenen is de radial node. De sigma-bindingen ontstaan door de bindingsoverlap tussen pz-type-orbitalen. Hoe meer overlap, hoe sterker de elektronenpaarbinding. In het geval van de C–C-bindingen reiken de pσ-orbitalen al tot elkaars angular nodal surface voordat de maxima van hun lobben samenvallen, wat minder overlap en dus minder stabilisatie veroorzaakt. Dit is anders voor de Si–Si-binding omdat, door de radial node in de Si 3pz AO’s, het maximum in de lob van het orbitaal in de richting van het andere atoom wordt geduwd, waardoor de p-orbitalen meer overlap hebben.’ Om het artikel te citeren: (…) de radial node van de Si 3pz-orbitaal (niet aanwezig in C 2pz) duwt het gebied van maximale amplitude van de 3pz-lob verder weg van de Si-kern. Deze omstandigheid vertraagt de out-of-phase overlap met de achterste lob van de 3pz [atoomorbitaal] van het andere Si-atoom, wat resulteert in een grotere maximale [pzpz]-overlap en dus een grotere Sbond [SOMO-SOMO bindingsoverlap] voor de Si–Si-binding dan voor de C–C-binding.




















Nog geen opmerkingen