In Bioconjugate Chemistry beschrijven Brusselse onderzoekers synthetische peptiden, gebaseerd op een nanobody, die aan een top-priority pathogeen binden. Dit opent wellicht routes naar nieuwe manieren om resistente bacteriën te bestrijden.
Antibioticaresistentie is een serieus, snelgroeiend probleem. Er komen nauwelijks nieuwe antimicrobiële middelen op de markt, terwijl het aantal multidrug-, extensively drug- en zelfs pandrug-resistant bacteriestammen alleen maar toeneemt.
Nieuwe strategieën om deze weerbarstige pathogenen aan te pakken zijn dringend gewenst en daarbij gaat de aandacht onder meer uit naar kleine peptiden (cel-penetrerende peptiden, CPPs, of antimicrobiële peptiden, AMPs) die aspecifiek aan de bacteriële membranen kunnen binden, ze kunnen penetreren of via elektrostatische interacties uit elkaar kunnen trekken. Juist het aspecifieke karakter van deze peptiden maakt de kans op de ontwikkeling van resistentie veel kleiner.
Extreme overlever
Eén van de meest zorgwekkende resistente pathogenen, volgens de Wereldgezondheidsorganisatie, is Acinetobacter baumannii. Deze Gram-negatieve bacterie is nauwelijks kapot te krijgen: resistent tegen een scala aan antibiotica, ongevoelig voor desinfectiemiddelen en kan lang overleven in extreme condities. A. baumanni hecht zich graag aan beademingsapparatuur en katheters en vormt daarmee een serieuze bedreiging voor de toch al kwetsbare patiënten die van deze apparatuur en hulpmiddelen afhankelijk zijn.
Nanobody
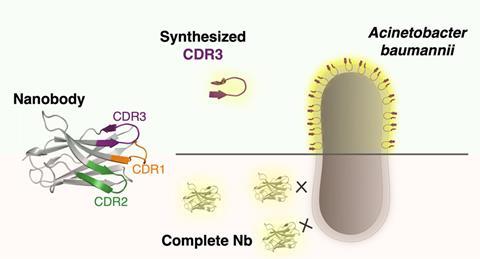
Het lab van Charles Van der Henst (VIB / VU Brussel) is nu gestuit op een zogeheten nanobody, een ‘klein’ antilichaam, dat bindt aan de buitenmembraan van A. baumannii. Nanobodies hebben drie complementarity-determining regions (CDRs), lus-achtige structuren die zorgen voor de herkenning en binding van het antigen, waarbij CDR3 een dominante rol speelt. Samen met de organische chemie-groep van Steven Ballet (VUB) besloten ze om op basis van de CDR3-sequentie van dit specifieke nanobody lineaire peptiden te synthetiseren om te zien of die ook aan A. baumannii binden.
Brug
Dat bleek een goede zet, een lineaire analoog van CDR3 wist zich aan meerdere, levende A. baumannii isolaten te hechten, in tegenstelling tot het complete nanobody dat alleen aan gefixeerde cellen kon binden. Om de lineaire peptiden meer te laten lijken op lusvormige CDRs en die structuur waarschijnlijk van belang is voor een robuust herkenning en binding, introduceerde het team een 1,2,3-triazool brug tussen de terminale residuen van het peptide. Een bijkomend voordeel van zo’n cyclische structuur is dat die beter bestand is tegen degradatie door proteases en dus langer actief blijft. Ook de cyclische versies binden goed aan A. baumanni en zijn stabieler dan de lineaire vormen.
Overigens vertaalt dit alles zich niet meteen naar een nieuw antibioticum, maar volgens de auteurs bieden deze peptiden wel een interessante optie om als aangrijpingspunt te dienen voor bijvoorbeeld peptide-drug conjugaten om zo heel gericht aan de bacteriële cellen te binden. Een belangrijk voordeel van deze kleine peptiden ten opzichte van intacte nanobodies is dat ze eenvoudiger en goedkoper te produceren zijn.




















Nog geen opmerkingen