Tumorcellen opzoeken en beïnvloeden met chemie is in een petrischaaltje gesneden koek. Maar wat als je echte tumoren bij echte mensen moet behandelen? Beeldgeleide chirurgie helpt om te bepalen waar je wel en niet moet snijden. ‘Het is echt afdelingsoverstijgend onderzoek.’
[geüpdatet: 18-9-2023]
Stel je bent chirurg en moet bij een patiënt een tumor verwijderen. Met het blote oog zie je misschien wel een zwelling, maar waar gezond weefsel ophoudt en ziek weefsel begint is zonder hulp niet zo makkelijk te bepalen. Ziehier de premisse van de beeldgeleide chirurgie: dit veld tracht tumorweefsel beter zichtbaar te maken zodat de chirurg precies weet – en vooral ziet – waar hij moet snijden. Maar dat is makkelijk gezegd: dit veld is enorm breed en vereist samenwerkingen tussen natuur-, genees- en scheikundigen om resultaten te boeken. We spraken drie onderzoekers die er verschillende werkwijzen op na houden, maar die wél allemaal hetzelfde doel hebben: patiënten zo goed mogelijk helpen.
‘Het veld bestaat al behoorlijk lang’, vertelt Fijs van Leeuwen, groepsleider van het Interventional Molecular Imaging Laboratory en hoogleraar Radiologie aan het Leids Universitair Medisch Centrum (LUMC). ‘In de jaren tachtig zie je de eerste onderzoeken over beeldgeleide chirurgie tevoorschijn komen. Ze werkten toen voornamelijk met radioactiviteit en antilichamen, waarbij je dus voor de operatie al met nucleaire geneeskunde kunt zien waar een tumor zich bevindt.’ In de jaren die volgden is het veld op de een of andere manier minder populair geworden, maar rond 2006 leefde het weer op door de opkomst van moleculaire beeldvorming. ‘Een aantal onderzoekers aan Harvard lieten de mogelijkheden van fluorescentie zien’, vervolgt Van Leeuwen. ‘Van daaruit zijn wij en verschillende andere groepen in dat veld gaan werken. Daarbij moet gezegd worden dat het in Japan al routinematig werd toegepast.’
Fluorescentie
Een van die andere groepen is de Optical Molecular Imaging Groningen onderzoeksgroep aan het UMC Groningen. Floris Voskuil is daar kaakchirurg in opleiding en postdoc. ‘We houden ons met name bezig met fluorescentiegeleide chirurgie, hoewel we ook steeds breder kijken naar andere beeldgeleide technieken’, zegt Voskuil. ‘Het doel is om laesies die je niet met het blote oog kunt zien zichtbaar te maken. Het is echt afdelingsoverstijgend onderzoek; iedereen die een goede indicatie heeft kan aansluiten bij de onderzoeksgroep.’
De insteek van Voskuil verschilt met die van Van Leeuwen, ondanks dat er wel overeenkomsten zijn. Beide groepen gebruiken chemische methodes om tumoren zichtbaar te maken, maar de focus ligt anders, legt de Groningse postdoc uit. ‘Wij doseren een fluorescente stof gekoppeld aan een tracer aan de patiënt. Die tracer, die bijvoorbeeld door zuur activeert, zoekt zijn weg naar de tumor waar een zuurder milieu heerst. Dat zorgt ervoor dat de fluorescente probe van de tracer afgaat en dus met een fluorescentiecamera oplicht. In de operatiekamer snijden we de tumor, met een aantal millimeter marge gezond weefsel, er zo goed mogelijk uit. Direct hierna bekijken we het uitgenomen weefsel, nog tijdens de operatie, onder de fluorescentiecamera. Licht de achterkant nog op? Dan zit er waarschijnlijk nog meer ziek weefsel en gaan we meteen door tot er geen fluorescentie meer te zien is. Zo is een tweede operatie of in ergere gevallen chemotherapie of bestraling niet meer nodig.’
Navigatiesysteem

Van Leeuwen is als afgestudeerd organisch chemicus vooral bezig met de technische aspecten en het chemische design en ziet juist meer voordelen in een hybride aanpak. ‘Ik vergelijk het met een navigatiesysteem. Daarin tik je je bestemming en als je dan de route volgt, kom je precies uit waar je moet zijn, in plaats van dat je op zoek moet naar een “lichtgevend huis”.’ Het idee is om op basis van radioactieve tracers een driedimensionale kaart te maken om naar het juiste chirurgische target te navigeren. Als de chirurg vervolgens in de buurt is van de laesie gebruikt hij of zij fluorescentie om de precieze locatie te identificeren.
Toen Van Leeuwen net begon (2006-2007), nam zijn groep de schildwachtklierprocedure als uitgangspunt. ‘Dat wordt gedaan met een technetium-nanocolloïd, ofwel een aggregaat van albumine waar je het radioactieve element technetium aan bindt’, zegt Van Leeuwen. ‘Spuit je dat in, dan gaat het met de lymfevloeistof mee naar de lymfeklieren, waardoor je in kaart kunt brengen hoe ver de metastase is. Vervolgens kun je de tumor met een gammastralingsdetector vinden.’
Maar de radioactiviteit is in de operatiekamer moeilijker terug te vinden als je naar complexere delen van het lichaam gaat, zoals de buik of de nek waar zich veel klieren bevinden. ‘We hebben toen een simpele chemische truc toegepast’, vervolgt Van Leeuwen. ‘We plakten de kleurstof indocyanine-groen aan technetium-nanocolloïd. Zo werd de klier zichtbaar met de gammadetector én de fluorescentiecamera. Dat is hoe we zijn begonnen en we hebben inmiddels al tweeduizend patiënten zo behandeld. De chemie was zo simpel dat een radiologisch1 laborant het kon, maar het beantwoordde wel de klinische vraag.’ Met dit concept in handen kun je vervolgens nieuwe moleculen ontwerpen, bijvoorbeeld tracers die klinisch gevalideerde tumorreceptoren zoals PSMA van prostaatkanker targeten.
‘De chemie was zo simpel dat een radiologisch1 laborant het kon, maar het beantwoordde wel de klinische vraag’
Fijs van Leeuwen
Winst

Ondanks de vorderingen in de groepen van Voskuil en Van Leeuwen is er – als je kritisch kijkt – hier en daar nog wel wat winst te behalen. ‘Met name op het gebied van tracers’, zegt Voskuil. ‘Die moeten specifieker en sneller op locatie komen. De gebruikelijke antilichamen zijn relatief groot en daardoor langzaam, dus zoeken we naar kleinere moleculen. Zo werken we ook samen met de faculteit scheikunde voor nanobodies die slim te activeren zijn, bijvoorbeeld met licht.’ Van Leeuwen beaamt de uitdagingen in het molecuulontwerp. ‘Er zijn heel veel factoren om rekening mee te houden: welk chelaat [een soort ligand, red.] matcht met het isotoop dat je wilt detecteren en hoe kun je de dye er vervolgens zó in bouwen dat het nog steeds een goede affiniteit en farmacokinetiek heeft, dus hoe het zich gedraagt in het lichaam?’
Een ander groot punt volgens Voskuil is de standaardisatie van beeldinterpretatie. ‘Je moet objectief kunnen kwantificeren hoeveel licht je ziet, of het van het oppervlak komt of juist dieper. De 2D-beelden zijn vaak lastig te interpreteren, dus we zijn met de natuurkundefaculteit bezig om te zien of we het weefsel transparant kunnen krijgen, en in meerdere groepen wordt het maken van 3D-beelden onderzocht.’ De groep van Van Leeuwen werkt zelf ook aan nieuwe camera’s en detectiemethodes. ‘Vooral in het begin was er niks beschikbaar, dus moesten we het zelf maken’, zegt de Leidse chemicus. ‘Tegenwoordig is er meer keus, maar het ontwikkelen gebeurt nog steeds, bijvoorbeeld om specifieke toepassingen in de opkomende robotchirurgie te faciliteren.’
‘We bekijken het uitgenomen weefsel, nog tijdens de operatie, onder de fluorescentiecamera’
Floris Voskuil
Hyperspectrale camera

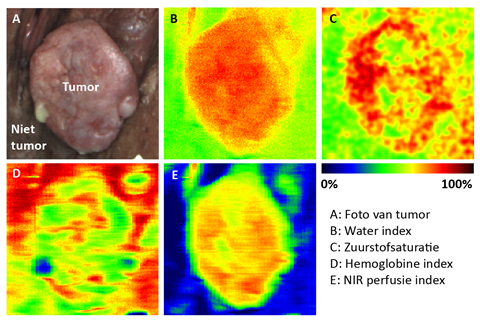
Een expert op het gebied van camera’s is Nick van de Berg, postdoc gynaecologische oncologie aan het ErasmusMC. Van de Berg is vanuit de instrumentenontwikkeling de imaging-hoek ingerold. Ook hij beaamt dat de noodzaak hoog is om tumoren beter zichtbaar te maken. Daarvoor gebruikt de groep waarin hij werkt de zogenoemde hyperspectrale camera. ‘Maak je met je mobieltje een foto, dan slaat het de afbeelding op in drie kleurkanalen: rood, groen en blauw, dus drie verschillende golflengtes’, vertelt Van de Berg. ‘Maar onze hyperspectrale camera kijkt naar wel honderd golflengtes die ook buiten het gebied van zichtbaar licht vallen. In dat geval heb je dus honderd verschillende meetpunten waar je een spectrum van kunt maken.’
Met die camera maak je dan foto’s van zowel gezond als ziek weefsel. De sleutel tot betere beeldinterpretatie is een grote hoeveelheid data, aldus Van de Berg. ‘We gebruiken daarom machine en deep learning om al deze data te analyseren. We zitten nu op zo’n dertig procent van de hoeveelheid data die nodig is om de leercurve te doorlopen, en in de tussentijd proberen we de onderliggende analyses verder uit te breiden.’
Maar wat kun je van zo’n hyperspectraal spectrum aflezen? ‘In die spectra zitten veel biochemische karakteristieken’, legt Van de Berg uit. ‘Met de camera kun je een inschatting maken van het vetpercentage, waterpercentage, zuurstofgehalte van het bloed en meer. De stap die we nu proberen te zetten is om op basis van die gegevens met deep learning te kunnen zeggen of het weefsel gezond of ziek is.’ Net als andere centra gebruikt het ErasmusMC fluorescentiegeleide chirurgietechnieken, maar dit is niet altijd even accuraat, zegt de postdoc. ‘Eenzelfde probleem heb je met de hyperspectrale camera: het spectrum kan lijken op dat van tumorweefsel, ook als het bij gezond weefsel hoort. Gecombineerd gebruik van deze technieken kan mogelijk uitkomst bieden. Het mooiste zou zijn om een camera te ontwikkelen die zowel hyperspectraal kijkt als gevoelig is voor fluorescentie, zodat de metingen elkaar kunnen versterken.’
‘Er wordt steeds strenger gekeken naar kunstmatige intelligentie en medische technologie’
Nick van de Berg
Sneeuwbaleffect
Hoe ziet de toekomst eruit? Steeds meer verenigd, aldus Voskuil. ‘Vroeger zagen we elkaar als concurrenten, maar nu is er meer harmonie. Dat heeft ook een praktische reden: wil je dat Zorginstituut Nederland de methodes goedkeurt en gaat betalen, dan moet je met grote multicenter studies komen.’ Van Leeuwen beaamt dat. ‘Je ziet een hoop overlap en duplicatie in de centra, maar juist het samenbrengen van de unieke signatures in de centra en specifieke aanpakken waarin ze verschillen zal de kracht van het veld worden.’
Volgens Van de Berg komen er wel spannende tijden aan. ‘Dat komt omdat kunstmatige intelligentie steeds meer ingezet wordt. Er staat op dat gebied veel te veranderen wat betreft wet- en regelgeving; er wordt strenger gekeken naar kunstmatige intelligentie en medische technologie en dus moet je je bevindingen steeds beter onderbouwen. Het doel voor mij is om zo transparant mogelijk te houden welke data we gebruiken voor onze beoordelingen. Het loont daarom juist om de software te trainen met variabelen die biochemische betekenis hebben. Dit zegt ons meer dan optische eigenschappen. Als we een tumor kunnen herkennen omdat het waterpercentage hoger is, dan is dat een duidelijk verhaal.’
Het onderzoeksveld wordt ook steeds breder, zien zowel Voskuil als Van Leeuwen. ‘Als je één dingetje aan bijvoorbeeld een tracer wilt veranderen, dan krijg je een sneeuwbaleffect naar alle andere disciplines’, aldus Van Leeuwen. ‘Daarbij moet je altijd terugkoppelen naar het molecuulontwerp. Je kunt niet zomaar chemisch wat gaan spelen, je moet echt iets ontwikkelen dat de zorgverzekeraar uiteindelijk wil vergoeden.’ ‘Je kunt het niet alleen’, zegt Voskuil. ‘Dokters en wetenschappers vullen elkaars expertises aan. De connectie tussen de medische, chemische en natuurkundige kant zie je steeds meer floreren. En wat helemaal mooi is’, besluit Voskuil, ‘we werken langzaamaan toe, op een veilige en verantwoorde manier, naar het klinisch implementeren van deze techniek. Hiermee kunnen we écht al iets betekenen voor patiënten.’
1. 18-9-2023. citaat aangepast naar ‘radiologisch laborant’. In tegenstelling tot chemisch laboranten genieten radiologisch laboranten geen chemische opleiding.















2 Opmerkingen van lezers