Gebruik je cyclometallatieliganden rond ijzer(III), dan heeft het een duizend keer langere geëxciteerde toestand. Het lijkt een eerste stap naar fotokatalyse met ijzer, aldus Duitse onderzoekers in Nature Chemistry.
Fotokatalyse is een van de opkomende technieken om solar fuels mee te maken. Tot nu toe werken onderzoekers vooral met het relatief efficiënte complex [Ru(bpy)3]2+, maar ruthenium is een vrij zeldzaam en duur overgangsmetaal. Veel liever zou je gebruik maken van metalen uit de rij daarboven, zoals ijzer, die veel meer voorkomen op aarde.
‘Daar heb je moleculen voor nodig die licht absorberen, lading scheiden en elektronen uit de omgeving kunnen halen’, vertelt Sylvestre Bonnet, hoogleraar bioanorganische chemie aan de Universiteit Leiden. Duitse onderzoekers van onder andere de universiteit van Paderborn lijken zo’n complex te hebben gevonden. Zij hebben een ijzercomplex gesynthetiseerd dat een voor ijzer lange geëxciteerde toestand heeft.
Zo’n geëxciteerde toestand is noodzakelijk voor fotokatalytische complexen. ‘Als een molecuul een foton opvangt, komt hij in een geëxciteerde toestand’, legt Bonnet uit, die zelf niet bij het onderzoek is betrokken. ‘Die toestand heeft een bepaalde levensduur. [Ru(bpy)3]2+ heeft voor de moleculaire wereld een redelijk lange toestand van een microseconde. De toestand van ijzer duurt meestal maar een paar picoseconde, maar in deze paper is het maximaal 4,6 nanoseconde, een behoorlijk verschil.’

Blauw
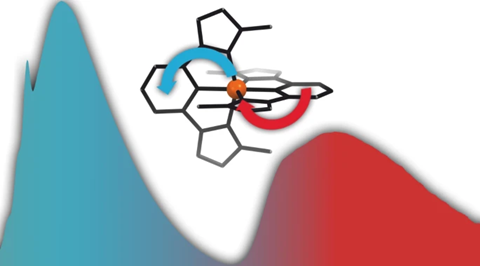
Het complex bestaat uit een ijzer(III)-ion met daaromheen twee dezelfde liganden die het ijzerion als het ware inpakken. Dat ligand bestaat uit een benzeenring met op de 1 en 3 positie een imidazole. Koolstof 2 van het benzeen en de koolstoffen tussen de stikstofatomen op de imidazolmoleculen fungeren als carbenen, koolstofatomen met een vrij elektronpaar, die het ligand doneert aan het ijzerion. Het resultaat is een blauw ijzercomplex dat stabiel blijft in water en lucht.
Normaal heeft ijzer verschillende geëxciteerde toestanden, zodat het molecuul in stapjes terug kan naar de grondtoestand. ‘Dat zorgt voor een veel kortere levensduur’, zegt Bonnet. ‘De onderzoekers wilden die intermediaire toestanden een hogere energie geven, zodat het niet stapsgewijs maar in één keer terugvalt.’ Dat deden ze met de carbenen, die heel elektronrijk zijn en zo de geëxciteerde toestanden verhoogt.
De interactie tussen liganden en metaalion zorgt ervoor dat twee geëxciteerde toestanden elkaar opvolgen: eerst een ligand metal charge transfer (LMCT) toestand van 240 ps, daarna een metal ligand charge transfer (MLCT) toestand van 4,6 ns, volgens de auteurs ‘the longest charge-transfer excited-state lifetime of iron complexes reported so far’. Wat ook nog niet eerder is aangetoond is de dubbele emissie (Janus-emissie) die plaatsvindt, resulterend in een helderblauwe kleur.
Supramoleculair
Het vervolg zou zijn om een geschikte katalysator te zoeken die door dit complex kan worden aangedreven voor katalytische reacties. ‘De 4,6 nanoseconde is langer de enkele picoseconden, maar het is nog kort vergeleken met de microseconde van ruthenium’, aldus Bonnet. ‘Maar misschien dat we niet zo ver hoeven gaan. Tussen de tien en honderd nanoseconde zou je al fotokatalyse kunnen doen, vooral als je de onderdelen vastzet in een supramoleculair omgeving zodat je de onderlinge afstand kort houdt waardoor elektronenoverdracht makkelijker wordt.’ De eerste stap is in ieder geval gezet.
Steube, J. et al. (2023) Nat. Chem., DOI: 10.1038/s41557-023-01137-w




















Nog geen opmerkingen